首次报道:胚系BRCA1/2突变乳腺癌患者,诊断为中枢神经系统转移后的生存期较短,软脑膜和颞叶受累率较高
2024-07-23 苏州绘真医学 苏州绘真医学
研究比较 BRCA1/2 携带者与非携带者乳腺癌患者的中枢神经系统转移特征和结局,发现前者软脑膜和颞叶受累率高,CNS 疾病生存期短。
乳腺癌是中枢神经系统(CNS)转移的常见原因,导致总体生存率显著降低。BRCA1/2中的胚系致病变异(PV)是乳腺癌最常见的遗传风险因素,与不良预后因素有关。本研究旨在探索BRCA1/2基因中存在胚系PV的乳腺癌患者的CNS转移模式和结局。回顾性研究队列,包括75名已知BRCA1/2突变状态的乳腺癌患者,这些患者在2006年至2021年期间被诊断出患有CNS转移。使用倾向评分匹配(1:2比例)来控制肿瘤受体状态(ER、PR、HER2)和患者年龄的可能影响,比较了BRCA1/2携带者(n=25)和非携带者(n=50)的组织病理学、CNS疾病特征、治疗和生存率。使用 Pearson卡方或Fisher精确检验和带有对数秩检验的Kaplan-Meier生存曲线进行统计分析。
BRCA1/2 PVs患者的高级别肿瘤更多(88% vs. 68%,P=0.060),CNS疾病诊断年龄更年轻(中位数46.69 vs. 55.02岁,P=0.003),ECOG体能状态更好(ECOG PS 0患者为20% vs. 2%,P= 0.033),但全身或CNS治疗方式无显著差异。BRCA1/2突变与颞叶受累率更高(52% vs. 26%,P=0.026)和软脑膜扩散率更高 (40% vs. 20%,P=0.020)相关。CNS疾病诊断后的生存期较短(中位数8.03个月 vs. 28.36个月,P<0.0001),但CNS转移的发展时间或总体生存期没有显著差异。
患有CNS转移性乳腺癌且BRCA1/2 PV的患者显示软脑膜和颞叶受累率较高,且CNS疾病患者的生存期较短。据研究者所知,这是第一项表明胚系BRCA1/2突变对CNS转移性乳腺癌具有独特影响的研究。
研究背景
乳腺癌是中枢神经系统(CNS)转移的常见原因,10%-16%的患者被确诊,在人类表皮生长因子2(HER2)过表达或三阴性乳腺癌患者中,转移率高达30%-50%。CNS转移性疾病的其他危险因素包括乳腺癌诊断时的年龄较小、肿瘤组织学分级高以及存在远处转移部位且转移部位数量较多。CNS疾病的诊断时间中位数为乳腺癌确诊后的16-54个月,通常是根据临床症状而定,因为目前尚无证据证明常规筛查或预防性治疗的益处。CNS转移的发生导致总体生存率显著降低,从确诊CNS疾病到死亡的中位数时间为16-25个月。
5-15%的乳腺癌存在遗传风险因素,最常见的是BRCA1或BRCA2突变,它们是与DNA损伤修复相关的肿瘤抑制基因。BRCA1/2的胚系致病变异(PV)与某些恶性肿瘤(如乳腺癌、卵巢癌、前列腺癌和胰腺癌)的高风险相关。在一项对10项研究的荟萃分析中,携带BRCA1致病变异的女性在70岁之前患乳腺癌的风险为57%,携带BRCA2致病变异的女性患乳腺癌的风险为49%。数据还表明BRCA1/2突变与不良预后因素之间存在关联,例如乳腺癌诊断时的年龄较小、高级别肿瘤,以及BRCA1突变(三阴性乳腺癌发生率更高)。
人们对BRCA1/2基因功能缺失与乳腺癌中枢神经系统受累模式之间的关联知之甚少。对BRCA1突变乳腺癌的研究表明,在控制年龄、疾病分期和肿瘤受体状态(ER、PR、HER2)等其他已知预后因素后,脑转移的发生率更高且更早。有限的数据还表明,BRCA2突变的乳腺癌脑转移率更高,与肿瘤组织学亚型无关。本研究旨在评估BRCA1/2 PV乳腺癌患者与BRCA野生型(BRCA-WT)患者相比的中枢神经系统转移模式和结果。
研究结果
CNS转移诊断前的研究人群比较:
CNS转移诊断前的临床、病理及治疗特征见表1。无BRCA PV患者乳腺癌诊断时平均年龄为49.0 ± 9.4岁(范围:25.7-66.6),而有BRCA PV 患者乳腺癌诊断时平均年龄为39.4 ± 10.3岁(范围:37.1-58.7),P < 0.0001。无论BRCA突变状态如何,所有患者乳腺癌诊断时的东部肿瘤协作组(ECOG)体能状态(PS)均为≤2。两组中最常见的组织学亚型均为浸润性导管癌(IDC)。所有患者的肿瘤级别均为中高(2-3级),BRCA1/2携带者的高级别肿瘤更多(88% vs. 68%,P = 0.060)。

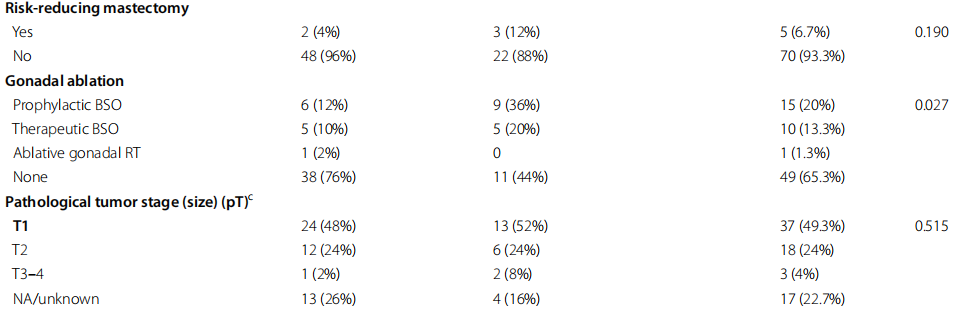
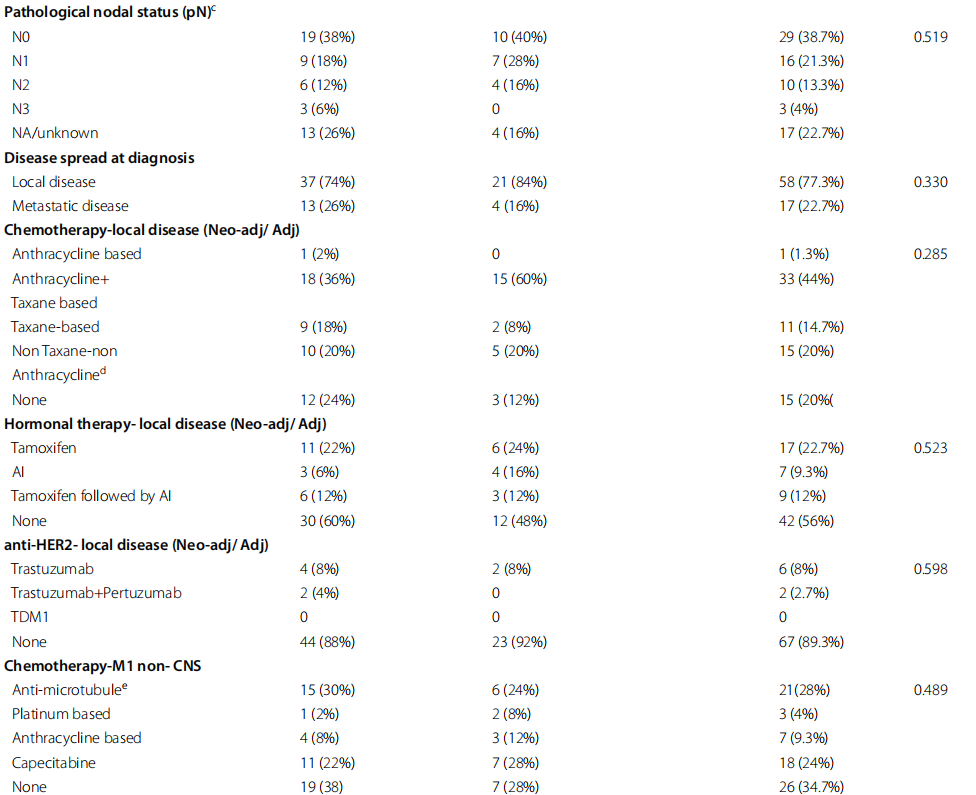
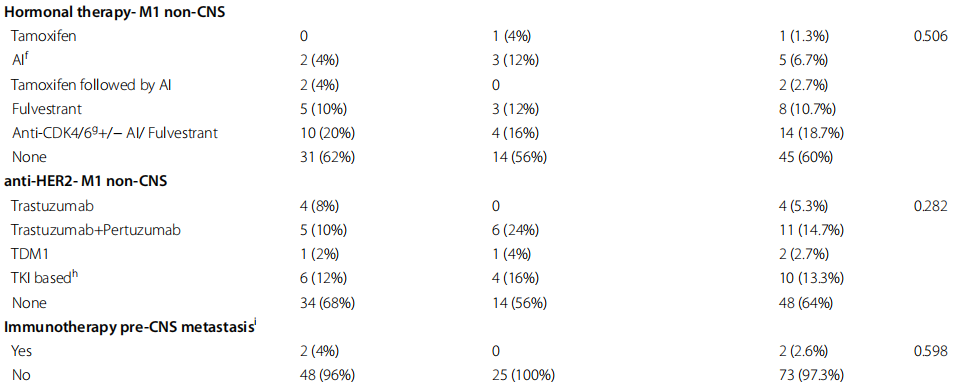
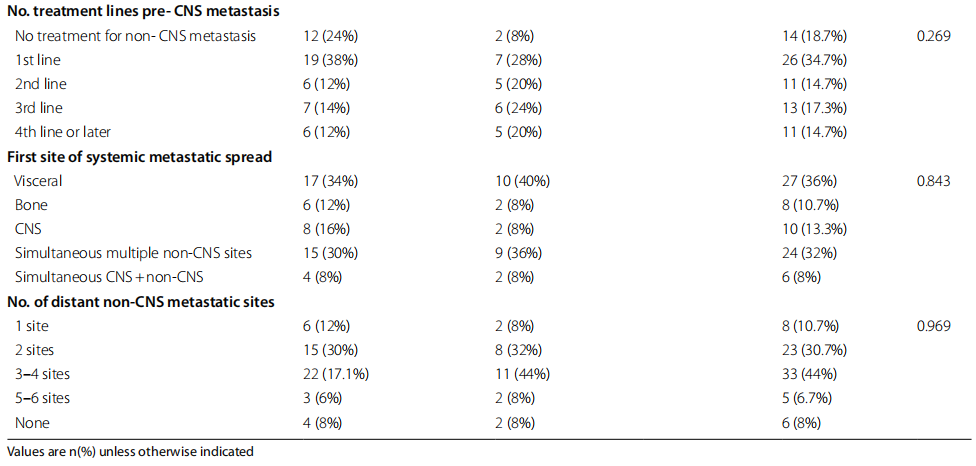

表1
两组的局部治疗方式相似,大多数患者接受乳房肿瘤切除术和局部放射治疗(占所有患者的46.7%)或乳房切除术(占所有患者的30.7%),并根据疾病分期和临床特征进行前哨淋巴结活检(SLNBx)或腋窝淋巴结清扫(ALND),并且与BRCA1/2状态相关的局部治疗方式没有显著差异。根据个体患者的决定和危险因素,12%的BRCA1/2 PV患者和4%的BRCA-WT患者进行双侧乳房切除术并预防性切除对侧乳房,差异无统计学意义(P=0.190)。
在BRCA突变组中,36%的患者接受了双侧输卵管卵巢切除术(BSO),而在BRCA-WT组中,这一比例为12%(P=0.027)。数例患者出于治疗目的接受了BSO或消融性性腺照射,以便抑制激素。
根据BRCA状态,肿瘤病理T分期或N分期无显著差异。无论BRCA状态如何,22.7%的患者在初次就诊时就被证实患有转移性疾病。
在两组中,大多数患者(占所有患者的44%)在诊断出转移性疾病之前接受了蒽环类和紫杉烷类治疗。每组中有两名患有三阴性疾病的患者在辅助治疗中接受了卡培他滨治疗,以在手术中获得非病理性完全缓解。激素敏感性肿瘤采用内分泌导向治疗、他莫昔芬和/或芳香酶抑制剂治疗,绝经前患者还接受了促黄体激素释放激素(LHRH)类似物治疗。HER2阳性肿瘤采用靶向HER2治疗,包括曲妥珠单抗单独使用或与帕妥珠单抗联合使用作为局部疾病治疗的一部分,联合化疗和作为此后的维持治疗。在匹配肿瘤受体状态和患者年龄后,与BRCA状态相关的局部疾病治疗没有显著差异。CNS转移前转移性疾病的全身治疗(包括化疗、内分泌和 HER2 靶向治疗以及免疫治疗)也相似。大多数患者接受了非CNS转移性疾病的全身治疗,在诊断为CNS疾病前,所有患者中34.7%的患者接受过一线治疗,14.7%的患者接受过四线或四线以上全身治疗。
根据BRCA状态,转移性疾病的部位没有差异。13.3%的患者在疾病出现时被诊断为CNS转移作为单一转移部位,8%的患者在疾病出现时同时诊断为CNS转移和其他远处转移部位。大多数患者有数个非CNS转移部位,在整个随访期间,每组中各有8%的患者仅有CNS疾病。
CNS转移诊断后的研究人群比较:
CNS转移诊断后,CNS受累的特征和CNS针对性治疗列于表2。非BRCA突变组诊断CNS转移时的平均年龄为55.0 ±10.4岁(范围:26.7-73.9岁),BRCA1/2突变组诊断CNS转移时的平均年龄为46.5 ±13.1岁(范围:30.0-78.3岁),P < 0.0001。更多BRCA PV 患者在诊断脑转移时体能状态良好(ECOG PS 0)(20% vs. 2%,P = 0.033),尽管此时两组中有大量患者因CNS疾病相关症状而出现功能恶化。
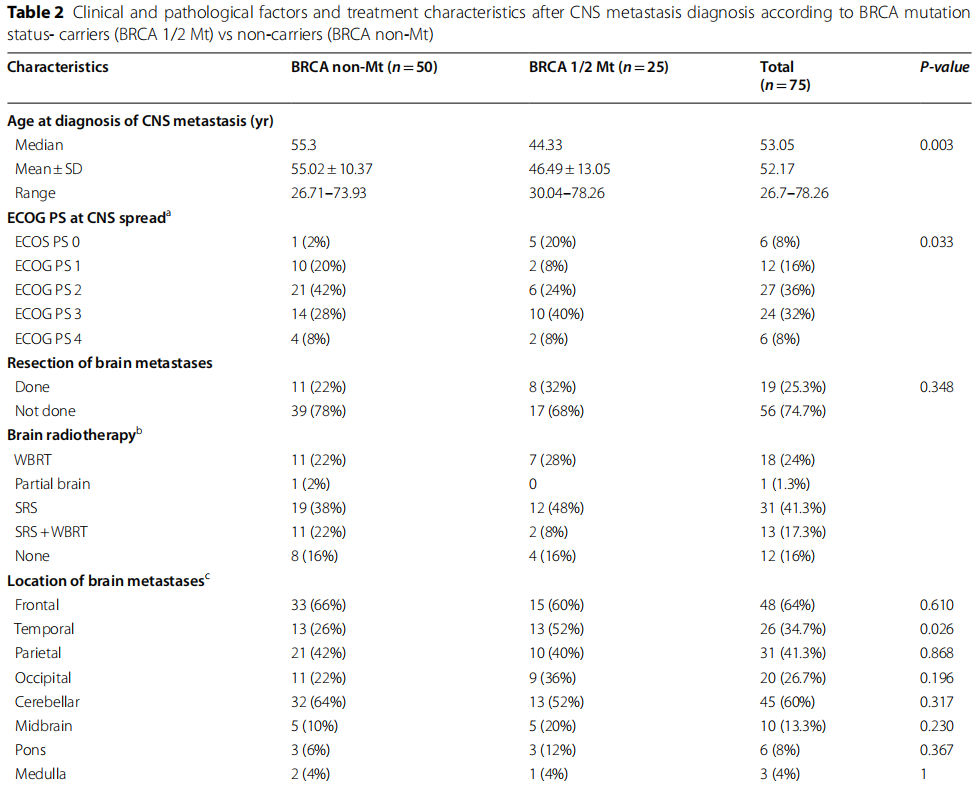

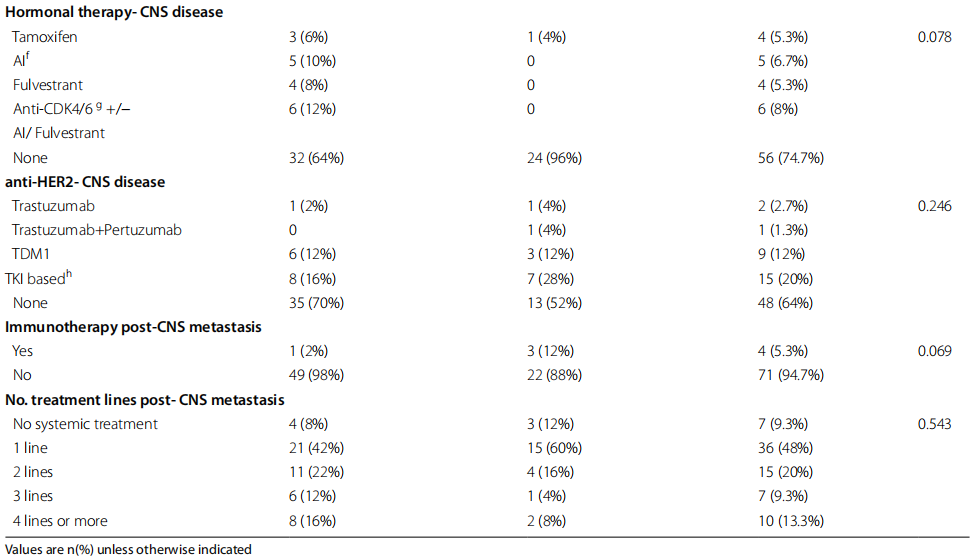

表2
针对CNS的治疗方面,两组间无显著差异。在确诊CNS疾病后,25.3%的患者接受了脑转移瘤手术切除,84%的患者接受了脑部放射治疗(WBRT-全脑放射治疗和/或SRS-立体定向放射外科治疗)。
根据脑成像(CT和/或MRI)检查脑沉积物的位置,在匹配肿瘤受体状态和患者年龄后,BRCA PV患者的颞叶受累发生率更高(52% vs. 26%,P=0.026),其他位置没有显著差异。两组中的大多数患者的疾病均扩散至脑幕上和脑幕下。与BRCA状态相关的脑沉积数量无显著差异,大量患者有≥6个脑沉积或弥漫性脑扩散,定义为大脑广泛受累,无法定义单个脑沉积。在BRCA PV患者中,软脑膜扩散的发生率更高(40% vs. 20%,P=0.020)。
两组患者在确诊CNS疾病后,全身治疗均以化疗为主,其中92.7%的患者接受了全身治疗。13.3%的患者在CNS扩散后接受了4线或4线以上的治疗。
在匹配肿瘤受体状态和患者年龄后,乳腺癌从诊断到CNS转移的时间与BRCA状态之间没有显著差异。非BRCA突变患者的CNS扩散中位时间为39.8个月(范围:18.2-61.2个月),BRCA突变患者的CNS扩散中位时间为48.9个月(范围:3.8-6.2个月)(χ2 (1)=0.467,P=0.494),见图1。BRCA PV患者确诊CNS转移后的生存时间较短,中位生存期为8.0个月(范围:7.5-8.5个月),而BRCA -WT患者为28.4个月(范围:21.2-35.5个月)(χ2 (1)=23.651,P<0.0001),见图2。
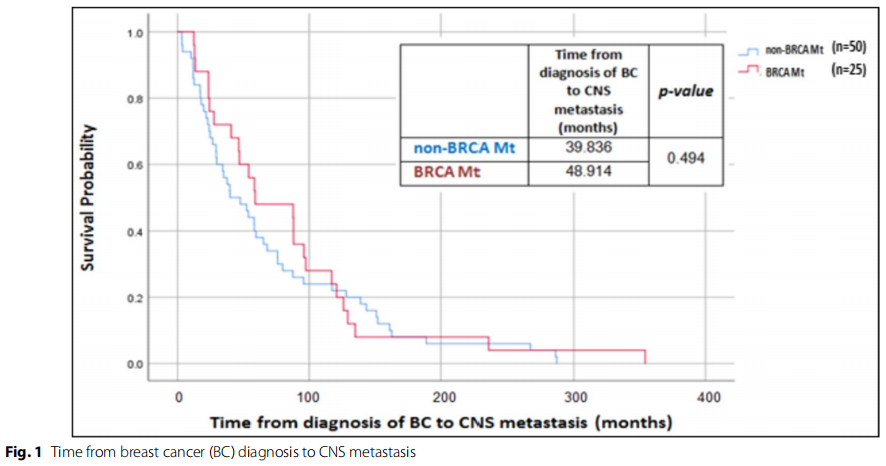
图1
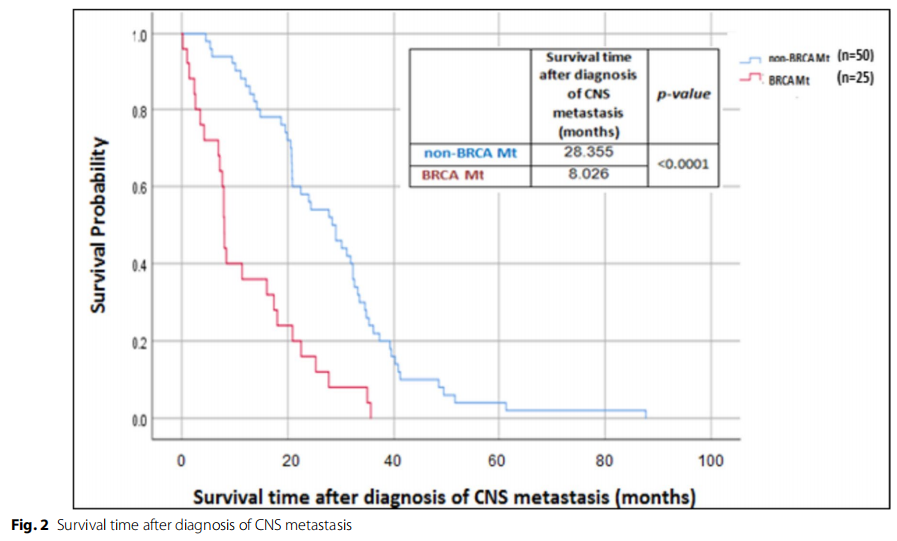
图2
从诊断乳腺癌到研究结束或死亡的中位总生存期:非BRCA突变患者为76.5个月(范围:60.6-92.4个月),BRCA突变患者为74.48个月(范围:20.06-128.29个月),匹配组之间没有统计学上显著差异(χ2 (1)=0.019,P=0.890),见图3。
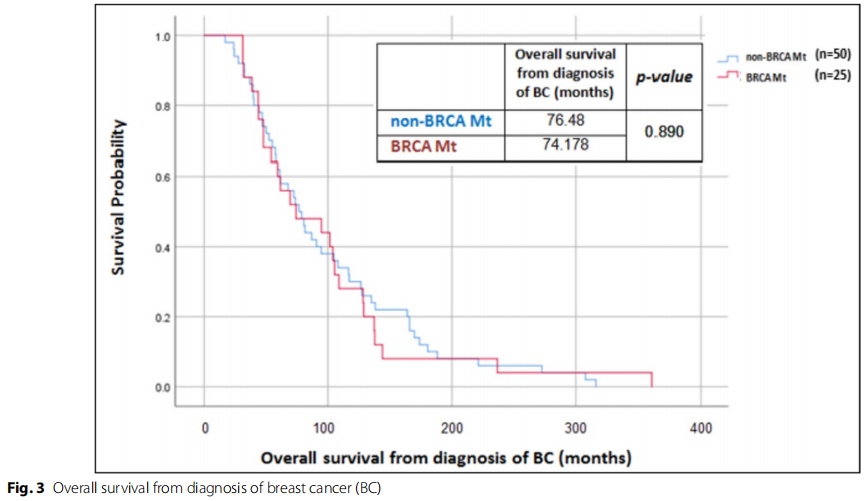
图3
讨 论
已知BRCA PV与乳腺癌诊断年龄较小有关,BRCA1突变患者的中位年龄为38岁,BRCA2突变患者的中位年龄为41岁,而非BRCA突变女性为43岁,并且对BRCA1突变患者,高级别肿瘤(87%)和三阴性乳腺癌(73%)的发病率更高。因此,在本研究中,BRCA突变患者的高级别肿瘤更多(88% vs. 68%,P=0.060)。在研究者之前的研究中,研究者发现年轻时(<45岁)确诊的乳腺癌患者在病程早期出现脑转移,对于三阴性乳腺癌患者,乳腺癌诊断年龄较小与CNS疾病诊断后生存时间较长相关。鉴于这些发现,研究者选择在控制乳腺癌诊断年龄和肿瘤受体状态(ER、PR、HER2)可能影响的情况下进行当前的数据分析。匹配年龄和受体状态后,本研究结果并未表明BRCA1/2突变患者的CNS扩散更早,并且两组从乳腺癌诊断到CNS疾病的中位时间都相对较长。
软脑膜癌病是肿瘤细胞通过脑脊液(CSF)扩散到软脑膜所导致的晚期并发症。研究表明,5%的乳腺癌患者在病程中会发展为软脑膜疾病,大多在晚期且存在多个全身部位的弥漫性转移性疾病。在本研究中,软脑膜疾病的发病率相对较高(占所有患者的26.7%),并且在存在BRCA1/2突变的情况下,40%的患者在随访期间出现软脑膜疾病,而没有BRCA突变的患者这一比例为20%(P=0.020)。从数据库中软脑膜疾病的高发病率来看,应该记住本研究人群完全由患有脑转移的女性组成,因此预计软脑膜受累的发病率将高于乳腺癌女性人群的发病率。例如,一项研究调查了接受SRS治疗的乳腺癌女性中软脑膜疾病的发病率,结果显示,25%的患者在接受SRS治疗一年后出现了软脑膜转移。软脑膜受累是乳腺癌的一个负预后因素,中位生存期仅为4.9个月。在本研究中,BRCA1/2突变的女性在被诊断为中枢神经系统疾病后,生存率较短,这可能是受到这一不良预后因素的影响。
在诊断CNS疾病时,BRCA1/2突变患者更年轻(中位年龄46.69岁 vs. 55.02岁,P=0.003),且体能状态更好(ECOG PS 0分别为20% vs. 2%,P=0.033)。早期研究表明,脑转移诊断时体能状态是影响患者生存的重要预后因素。在本研究中,尽管BRCA突变组存在优势,但诊断CNS疾病后的生存时间更短。
在CNS扩散之前或之后给予的局部或全身治疗方式的类型没有显著差异,在已知可穿透血脑屏障并因此可影响CNS转移性疾病的发病率和病程的治疗方面也没有显著差异,例如卡培他滨、恩美曲妥珠单抗(TDM1)或阿贝西利。值得注意的是,本研究的数据分析是在常规使用新一代靶向HER2疗法(德曲妥珠单抗;ENHERTU)等治疗方法治疗HER2阳性转移性疾病之前,以及在使用奥拉帕利(Lynparza)作为辅助治疗(这些患者患有胚系BRCA突变的HER2阴性高危早期乳腺癌,并在手术前后接受过化疗)之前。
检查CNS扩散的特征,在匹配患者年龄和肿瘤受体状态后,本研究的数据显示BRCA突变患者的颞叶受累率更高(52% vs. 26%,P = 0.026),而脑转移的其他位置没有显著差异。在文献综述中,只有少数研究检查了可能影响乳腺癌CNS扩散位置的参数,其中大多数与肿瘤受体状态(ER、PR、HER2)的影响有关。一项对60例乳腺癌脑转移患者的回顾性研究显示,ER阴性HER2阳性肿瘤有多发性脑转移(6 例或以上)的发生率更高,为61%,而其他肿瘤亚型的36%(P=0.002),脑干转移(61% vs. 11.5%,P=0.002)和枕骨转移(66.7% vs. 30.8%,P=0.029) 的发生率也更高。2018年以摘要形式发表的一项研究纳入了50例乳腺癌脑转移患者,其中ER阳性HER2阳性肿瘤显示小脑转移的发生率更高(P<0.05)。另一项研究分析了100名已知患有中枢神经系统疾病的乳腺癌患者的MRI扫描结果,结果显示HER2阳性和/或ER阳性肿瘤的枕叶和小脑转移率较高,而三阴性肿瘤的额叶、顶叶和边缘区域受累率较高(P<0.05)。
CNS疾病扩散的位置会影响临床表现,并可能对预后产生影响。2023年发表在BMC cancer上的一项研究表明,BRCA突变的转移性乳腺癌患者的癫痫发作率更高,本研究关于BRCA突变携带者中枢神经系统扩散差异的结果可以解释这些发现。另一项研究表明,无论临床病理因素如何,乳腺癌脑转移患者的BRCAness与较短的总生存期相关。
本研究受到回顾性和非随机设计的局限性,样本量相对较小,随访期较短。此外,研究人群反映了治疗模式随时间的变化,局部和全身治疗、成像方式取得了进步,并且越来越多地使用分子检测来指导个体化患者治疗。本研究的优势包括每个患者的详细信息,例如疾病过程中的肿瘤特征、局部和全身治疗以及其他重要的预后因素。患者在一个机构接受治疗,诊断、治疗和随访指南统一。此外,使用配对分析进行比较使研究者能够抵消其他预后变量的可能影响,从而进一步研究可归因于BRCA突变状态的独特差异。
在这项针对CNS转移性乳腺癌的1:2配对分析中,携带BRCA1/2基因胚系致病变异(PV)的患者在CNS疾病和预后方面表现出独特的特征,在控制患者年龄和肿瘤受体状态(ER、PR、HER2)的情况下也是如此,尽管其他已知预后因素或临床管理方面没有明显差异。在存在BRCA1/2突变的情况下,软脑膜和颞叶受累率较高,并且在诊断出CNS疾病后生存期较短。有必要对更多患者进行更长时间的随访研究。
参考文献:
Ben-Zion Berliner M, Yust-Katz S, Lavie I, Goldberg Y, Kedar I, Yerushalmi R. Central nervous system metastases in breast cancer patients with germline BRCA pathogenic variants compared to non-carriers: a matched-pair analysis. BMC Cancer. 2024 Feb 16;24(1):219. doi: 10.1186/s12885-024-11975-7. PMID: 38365640; PMCID: PMC10870547.

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#乳腺癌# #中枢神经系统转移#
70