Lancet Haematol:Melflufen联合地塞米松治疗复发性或难治性多发性骨髓瘤
2022-02-07 Nebula MedSci原创
与泊马度胺联合地塞米松相比,Melflufen联合地塞米松显著延长了复发性或难治性多发性骨髓瘤患者的无进展生存期。
Melflufen (Melphalan flufenamide) ,Melphalan的一种二肽前体药物,是一种烷基化剂。一项2期HORIZON研究展示了Melflufen联合地塞米松一起应用的临床活性和可控的安全性。
本研究旨在明确:相比泊马度胺联合地塞米松,Melflufen联合地塞米松是否可进一步延长既往治疗过的多发性骨髓瘤患者的无进展生存期。
这是一项随机、开放标签、头对头的3期临床试验(OCEAN),招募了年满18岁的ECOG表现状态0-2分的多发性骨髓瘤患者(大多为复发/难治性)。受试患者被1:1随机分至两组,并根据年龄、既往治疗次数、国际分期系统评分进行分层。Melflufen组患者每个28天疗程的第1天静滴Melflufen 40mg,泊马度胺组患者每28天疗程的第1-21天每天口服4mg泊马度胺,两组患者每疗程的第1/8/15和22天各口服40mg地塞米松。主要终点是无进展生存期。
2017年6月12日-2020年9月3日期间,共有495位患者(中位年龄 68岁)被随机分至Melflufen组(246位)或泊马度胺组(249位)。474位患者至少接受了一剂研究药物(Melflufen组 228位,泊马度胺组 246位)。
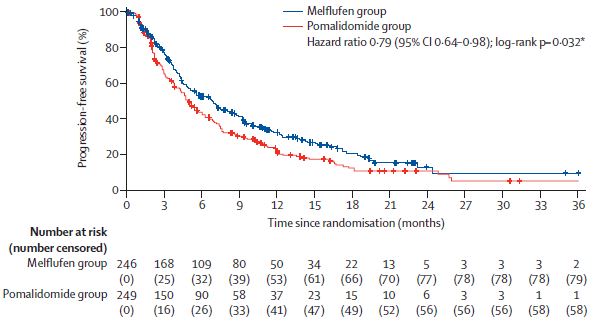
中位无进展生存期
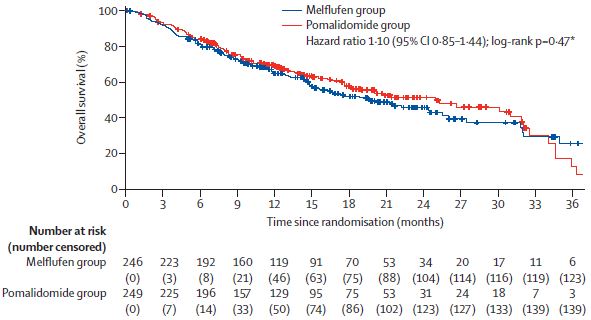
截止2021年2月3日,Melflufen组和泊马度胺组分别中位随访了15.5个月和16.3个月,中位无进展生存期分别是6.8个月和4.9个月(风险比[HR] 0.79,95% CI 4.2-5.7, p=0.032)。Melflufen组和泊马度胺组分别中位随访了19.8个月和18.6个月时,中位总生存期分别是19.8个月和25.0个月(HR 1.10, 95% CI 0.85-1.44, p=0.47)。
中位总生存期
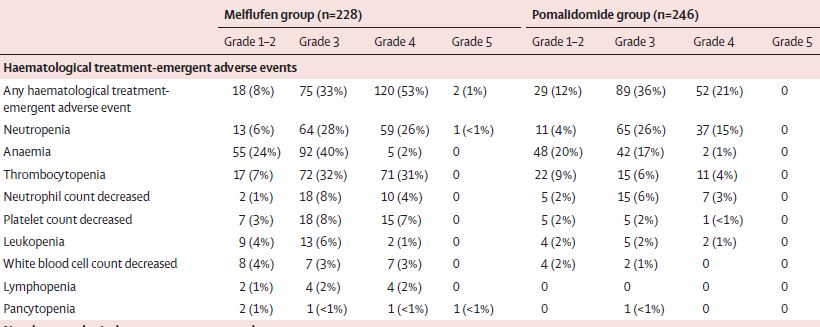
最常见的3-4级需紧急治疗的副作用有血小板减少症(Melflufen组 vs 泊马度胺组:63% vs 11%)、中性粒细胞减少症(54% vs 41%)和贫血(43% vs 18%)。Melflufen组和泊马度胺组分别有95位(42%)和113位(46%)患者发生了严重的需紧急治疗的副作用,最常见的有肺炎(6% vs 9%)、新冠肺炎(5% vs 4%)和血小板减少症(4% vs 1%)。
两组常见的血液学副反应
综上,与泊马度胺联合地塞米松相比,Melflufen联合地塞米松显著延长了复发性或难治性多发性骨髓瘤患者的无进展生存期。
原始出处:
Fredrik H Schjesvold, Meletios-Athanasios Dimopoulos, Sosana Delimpasi, et al. Melflufen or pomalidomide plus dexamethasone for patients with multiple myeloma refractory to lenalidomide(OCEAN): a randomised, head-to-head, open-label, phase 3 study. Lancet Haematol 2022;9: e98–110. https://doi.org/10.1016/S2352-3026(21)00381-1.
作者:Nebula
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#Melflufen#
59
#HAE#
0
#多发性#
70
#Lancet#
75
#复发性#
60