Brain: 克里斯蒂安森综合征新动物模型
2022-01-26 brainnew神内神外 网络
克里斯蒂安森综合征(Christianson Syndrome (CS))是一种罕见的X染色体隐形遗传病,多见于男性患病。患者自出生后表现出小头畸形、发育迟缓、言语障碍、癫痫和进行性小脑共济失调等症状
内溶酶体系统异常与神经退行性和神经发育疾病相关,比如NHE6突变引起的克里斯蒂安森综合征((Christianson Syndrome)CS)。NHE6是一种内体跨膜蛋白,可调节内体的 pH 值以及内体转运和信号传导。研究发现,NHE6的缺失会导致溶酶体功能异常和内体成熟及转运的障碍,靶向调控NHE6时也会改变淀粉样蛋白 β (Aβ)的水平。另外,NHE6表达水平与tau蛋白沉积呈现反比关系。
为研究 CS 神经变性以及Aβ和tau病理学的可能性,来自于布朗大学的Eric M Morrow团队构建了NHE6 缺失的CS大鼠模型(NHE6-null)。这一模型能够更好地展示神经发育病变、内源性Aβ和tau蛋白沉积,并且能够在整个生命周期观察到NHE6敲除所导致的神经发育与神经退行性病变及其时间顺序。
克里斯蒂安森综合征(Christianson Syndrome (CS))是一种罕见的X染色体隐形遗传病,多见于男性患病。患者自出生后表现出小头畸形、发育迟缓、言语障碍、癫痫和进行性小脑共济失调等症状,并且伴有进行性神经退行性病变。CS是由X染色体连锁的内体NA+/H+交换器(NHE6,由SLC9A6基因编码)发生突变所引起的。NHE6 突变携带者的一部分女性可能在临床上被诊断出患有与 tau 沉积相关的疾病,例如皮质基底节变性、进行性核上性麻痹和非典型帕金森症。
1. NHE6-null大鼠的构建
在SD大鼠的Slc9a6基因(编码NHE6)的7号外显子插入两个碱基对TT,从而形成终止密码子TGA(图1C),导致Slc9a6转录和翻译缺失,无法编码完整的NHE6蛋白。

图1构建NHE6-null大鼠
2. NHEE6-null大鼠表现出早期的溶酶体损伤且早于自噬异常
小脑退化是CS患者的一个显着特征。为了进一步观测小脑病变,研究者利用钙结合蛋白Calbindin来显示小脑的浦肯野细胞,发现NHE6-null大鼠早在1月龄时小脑浦肯野细胞就显著减少,且神经节苷脂GM2沉积显著增加,表明溶酶体出现功能缺陷(图2A-B)。进一步研究发现,NHE6-null大鼠在2月龄时开始表现出自噬蛋白p62和泛素蛋白Ub的沉积增加,提示着自噬功能障碍(图2C-D)。这些结果表明,溶酶体损伤是小脑中的主要病变,最早发生并与浦肯野细胞减少同时发生,自噬缺陷随之而来。

图2 NHE6-null大鼠表现出早期的小脑病变
3. NHE6-null大鼠出现神经元死亡和轴突病变
类似于在小脑观察到溶酶体缺陷和自噬异常的现象,在海马体和杏仁核中3月龄就能观察到溶酶体缺陷,且呈现年龄依赖性积累效应,直到18月龄时才检测到自噬功能的异常。然而,神经元的丢失发生在12月龄才开始发生。在12月龄的NHE6-null大鼠的海马、梨状/内嗅皮层和杏仁核中可以观察到脑萎缩和细胞丢失(NeuN+细胞显著减少)以及脑室扩大(图3A),并且在CA3 也观察到多灶性空泡化(图 3B)。另外,皮层和胼胝体中的银染显着减少,并且伴有多灶性空泡化(图3E-F),反映了轴突传递的缺失及背后的内体功能障碍。
 图3 NHE6-null大鼠表现出神经元丢失和轴突病变
图3 NHE6-null大鼠表现出神经元丢失和轴突病变
4. NHE6-null大鼠出现晚期的tau蛋白沉积病变
为了研究 NHE6 缺失大鼠中异常 tau 积累的可能性,研究者检测了不同月龄时tau的溶解度以及沉积水平,发现NHE6-null大鼠在18 月龄时表现出Sarkosyl不溶性tau蛋白的显著增加,且总磷酸化tau蛋白与总tau蛋白水平的比值也显著升高(图4A)。总磷酸化tau蛋白AT8和PHF1主要在海马、皮层的成熟神经元以及胼胝体的星型胶质细胞中(图 4B-D)。
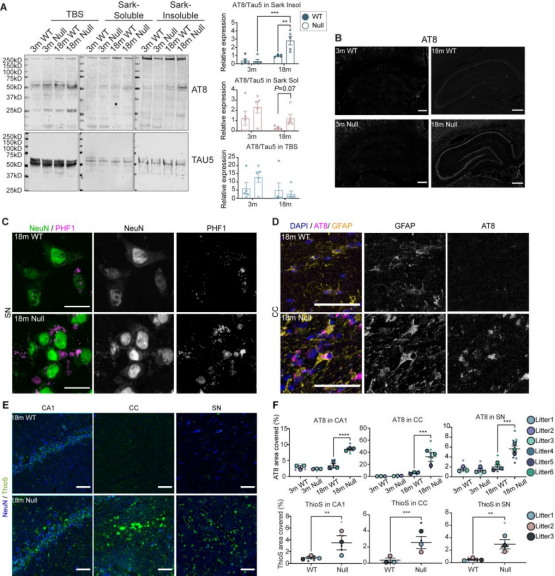
图4 NHE6-null大鼠晚期表现出tau蛋白沉积
5. 老年NHE6-null大鼠表现出Aβ的沉积
NHE6缺失会导致内体酸化,并且内体pH 值的降低被认为会增加β-分泌酶的活性,促使Aβ生成,但是这一假说还没有得到证实。研究者发现在24月龄中没有观察到总Aβ或Aβ40的增加。然而,在NHE6-null大鼠18月龄时在盐酸胍(GuHCl)可溶性部分中Aβ种类的增加,在TBS可溶性部分的相应减少(图5A-J),并且可以观察到细胞外有Aβ斑块(6E10)和寡聚淀粉样蛋白原纤维(OC)沉积(图5K-L),表明有很强的Aβ聚集效应。

图5 NHE6-null大鼠表现出Aβ的表达增加和胞外沉积
综上,该研究构建了NHE6功能缺失大鼠,阐述了由于NHE6敲除所导致的神经发育和神经退行性病变的类型以及发生进程,并且明确了大脑和小脑中溶酶体缺陷发生早于自噬功能障碍和Aβ、tau蛋白沉积。这一动物模型的构建将为CS的研究提供一个新模型,并且为研究内溶酶体异常与涉及蛋白质聚集的神经变性之间的联系提供了证据。
参考文献
Lee Y, Miller MR, Fernandez MA, Berg EL, Prada AM, Ouyang Q, Schmidt M, Silverman JL, Young-Pearse TL, Morrow EM. Early lysosome defects precede neurodegeneration with amyloid-β and tau aggregation in NHE6-null rat brain. Brain. 2021 Dec 20:awab467. doi: 10.1093/brain/awab467. Epub ahead of print. PMID: 34928329.
编译作者:Sybil (brainnews创作团队)
校审:Charlie Brown (brainnews编辑部)
作者:brainnew神内神外
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#综合征#
132