罕见病例|以肝硬化为主要表现的红细胞生成性原卟啉病1例
2024-05-10 临床肝胆病杂志 临床肝胆病杂志
卟啉病是血红素生物合成途径中的酶活性缺乏,引起卟啉或其前体浓度异常升高,并在组织中蓄积,造成细胞损伤而引起的一类遗传代谢性疾病。
1病例资料
患者男性,38岁,已婚。于2022年10月30日因“日照后皮肤烧灼感30余年,黄疸、腹痛1周”入院。患者诉自儿童时期起日照数分钟后双手、面部皮肤出现烧灼感,可出现红斑、丘疹、结痂,浸泡冷水可缓解皮损疼痛感,避免日照数日后皮损可消退,曾多次于外院皮肤科就诊,未明确病因。患者2022年10月因“牙痛”服用“阿莫西林、布洛芬”后出现尿黄,再次出现日照后面部、双手烧灼感,数天后皮肤烧灼感好转,逐渐出现红斑、丘疹、结痂,入院前1周出现皮肤、巩膜黄染,伴有持续性重度腹痛、顽固性便秘、入睡困难,2022年10月29日外院查TBil 429.00 μmol/L,DBil 280.00 μmol/L,ALT 149.00 U/L,AST 161.00 U/L,GGT 465.00 U/L,ALP 419.00 U/L。否认传染病史,偶有少量饮酒,配偶身体健康,育有1子,家族中无类似病史。
BMI 21.00 kg/m2,神志清楚,计算力、定向力正常,面色晦暗,皮肤、巩膜重度黄染,未见肝掌、蜘蛛痣,无淤点淤斑,双侧手背可见多发红斑、丘疹,部分丘疹破溃结痂(图1、2)。心肺未见异常。腹部稍膨隆,腹软,上腹部压痛,无反跳痛,肝脾肋下未触及,叩诊鼓音,移动性浊音阴性,肠鸣音减弱,2次/min。神经查体未见异常。
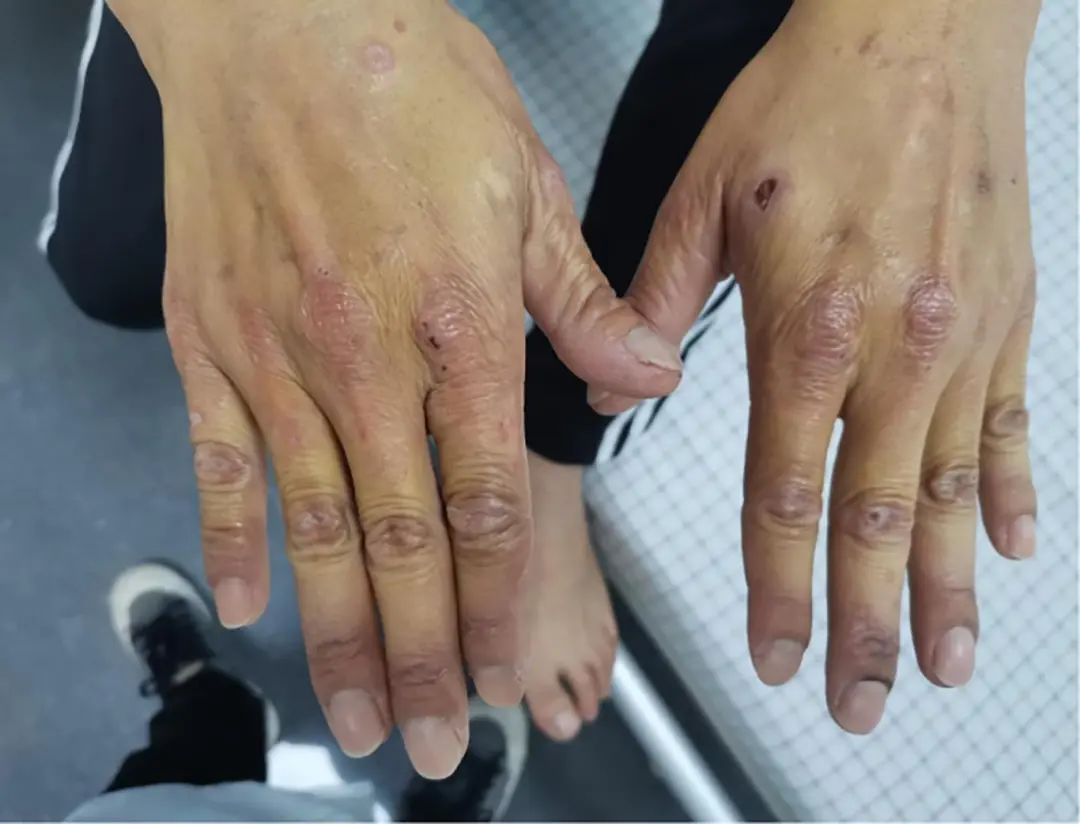
注:双侧手背多发红斑,丘疹,部分破溃结痂。
图1 手部皮肤(急性期)
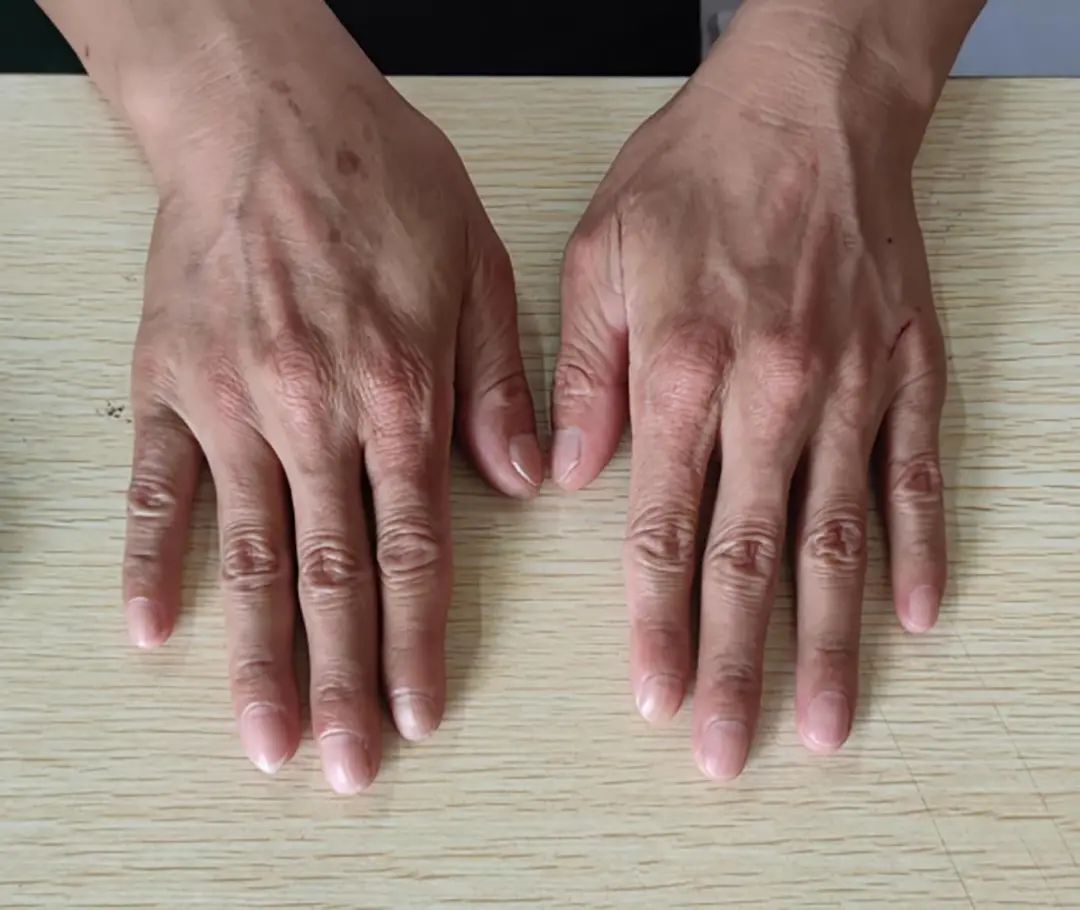
注:未遗留疤痕及色素沉着。
图2 手部皮肤(缓解期)
血常规:WBC 5.56×109/L、Hb 104 g/L、PLT 30×109/L。凝血功能:PTA 78.9%,INR 1.10。肝功能:TBil 379.20 μmol/L,DBil 341.06 μmol/L,Alb 37.00 g/L,ALT 113.10 U/L,AST 157.20 U/L,ALP 355.70 U/L,GGT 410.60 U/L,血清总胆汁酸256.00 μmol/L。铁代谢:血清铁蛋白86 ng/mL,血清铁9.77 μmol/L,总铁结合力34.97 μmol/L,未饱和铁结合力25.20 μmol/L。血脂代谢:LDL-C 3.05 mmol/L,TG 2.67 mmol/L。HAV IgM抗体、HBsAg、HCV抗体、HEV IgM抗体均阴性。EBV荧光定量、CMV荧光定量均<500 拷贝/mL。自身免疫性肝病抗体谱(抗线粒体抗体M2、抗肝细胞胞浆Ⅰ型抗体、抗可溶性肝抗原抗体、抗pg210抗体、抗sp100抗体、抗肝肾微粒体抗体)、抗核抗体、抗中性粒细胞胞浆抗体未见异常。血铅、铜蓝蛋白、IgG4未见异常。上腹部CT平扫+增强示:肝硬化、脾大、门静脉高压并侧支循环形成,急性胆囊炎可能,少量积液。
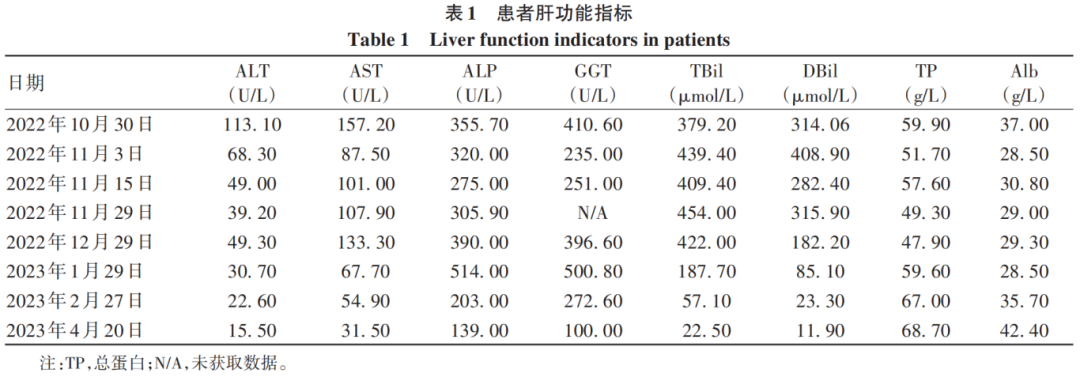
入院后结合患者病史、查体、辅助检查,排除病毒性、自身免疫性、酒精性等常见肝硬化病因,并排除血色病、肝豆状核变性、肝血管性疾病等少见肝脏疾病,患者发病前有服药史但不能解释肝硬化病因;患者长期有非起泡性皮肤光敏性,存在严重腹痛、顽固性便秘,排除肠梗阻引起,综上考虑患者为遗传代谢性肝病卟啉病。治疗上予以避光、卧床休息、止痛、通便、丁二磺酸腺苷蛋氨酸、还原型谷胱甘肽、苷草酸单氨半胱氨酸、熊去氧胆酸、碳水化合物负荷(口服或静脉输注葡萄糖300~400 g/d)等治疗,但患者腹痛、便秘未见缓解。2022年11月3日复查肝功能:TBil 439.40 μmol/L,DBil 408.90 μmol/L,Alb 28.50 g/L,ALT 68.30 U/L,AST 87.50 U/L,ALP 320.00 U/L,GGT 235.00 U/L,建议行肝穿刺活检,患者拒绝,考虑患者病情危重,转至中山大学附属第三医院治疗,外送基因检测,结果提示亚铁螯合酶(FECH)基因存在2个杂合突变:c.1078-1G>T(splicing)染色体位置chr18:55218607,c.951A>T(p.Glu317Asp)染色体位置chr18:55221618,疾病表型为红细胞生成性原卟啉病(EPP),遗传方式为常染色体隐性遗传。确诊为EPP,予以对症治疗未见好转,建议行肝移植治疗,患者拒绝并出院。2022年12月1日至中南大学湘雅医院就诊,予以对症处理,建议患者肝移植治疗,患者仍然拒绝,并行血浆置换治疗1次,症状未见好转后出院。出院后口服中药及丁二磺酸腺苷氮蛋酸肠溶片等,规律复查肝功能(表1),患者腹痛、便秘、黄疸等症状逐渐好转。
2讨论
卟啉病是血红素生物合成途径中的酶活性缺乏,引起卟啉或其前体浓度异常升高,并在组织中蓄积,造成细胞损伤而引起的一类遗传代谢性疾病。根据酶的缺陷可分为8种类型:X连锁原卟啉病、ALA脱水酶卟啉病、急性间歇性卟啉病、先天性红细胞生成性卟啉病、家族性/散发性迟发性皮肤卟啉病、遗传性粪卟啉病、变异性卟啉病及EPP。按照临床表现可分为急性神经内脏卟啉病、慢性起泡性皮肤卟啉病和急性非起泡性皮肤卟啉病。EPP属于急性非起泡性皮肤卟啉病,主要表现日照后数分钟内出现皮肤烧灼感和显著疼痛,在世界范围内其患病率为(5~13.3)/100万,不足5%的病例合并原卟啉性肝病,本文以急性腹痛及肝病为主要表现的病例极其罕见。
EPP是一种罕见遗传代谢性疾病,在FECH亚效等位基因突变IVS3-48T>C被发现之前,EPP被认为是FECH基因突变引起的常染色体显性遗传性疾病。FECH基因可编码血红素生物合成途径最后一个酶,即亚铁螯合酶(FECH);而亚效等位基因突变IVS3-48T>C可引起异常剪接位点的应用增多,生成更易降解的mRNA,导致FECH减少,即FECH双等位基因功能丧失性突变,导致FECH活性降低到正常值的30%以下,引起原卟啉过度蓄积。由于致病条件为双等位基因功能丧失性突变,因此EPP是一种常染色体隐性遗传疾病。IVS3-48T>C基因突变在白种人群的发生率约为10%,在黄种人群更常见。一项日本的流行病学调查提示在日本人群中IVS3-48T>C基因突变发生率约为45%。基于遗传学分析,建议患者直系亲属行基因检测,因患者亲属目前无类似表现及费用问题,并未行基因检测,但患者育有1子,6个月龄,EPP常于儿童时期发病,该婴儿有50%概率遗传父亲的重度表型FECH突变基因,是否会发病取决于母亲是否携带亚效等位基因突变IVS3-48T>C,该等位基因突变在中国人群中较常见,因此尽早对其儿子及妻子行基因检测有利于早期诊断及干预,改善预后。
原卟啉是一种光敏性物质,吸收光能后呈一种激活状态,产生大量氧自由基,通过蛋白、脂质、DNA过氧化作用导致组织损伤,原卟啉大量存在血浆、红细胞内,由于其疏水性,在皮肤脂质层大量蓄积,通过氧化作用引起血管内皮、皮肤组织损伤。肝脏是原卟啉唯一的排泄器官,原卟啉在肝脏大量蓄积可引起肝细胞及胆管细胞损伤,导致原卟啉排出减少,发生原卟啉性肝病。原卟啉损伤也见于神经系统,机制尚不明确,可能是血红素生物合成途径的中间产物或其衍生物具有神经毒性。
由于对EPP的认识较少,临床上常导致误诊及延误治疗。美国一项纳入129例患者的研究发现,从出现症状到最终诊断为EPP的平均延后时间是13年。本病例被误诊及延误治疗30余年,因此有必要提高对EPP临床症状的认识。结合其发病机制,EPP的临床症状主要为:(1)急性非起泡性皮肤光敏反应。表现为皮肤日照数分钟后出现烧灼感、针刺感,症状持续数小时至数天,避免日照后可缓解,长时间照射可出现丘疹、红斑并伴有破溃结痂,较少出现疱疹、疤痕。首次出现皮肤光敏反应常于儿童时期,一项研究中76%的患者于4岁以前发病。(2)肝功能损伤。EPP发生肝病较少见,原卟啉性肝病是一种胆汁淤积性肝病,表现为转氨酶升高、肝硬化,严重时可导致肝衰竭。(3)神经内脏功能障碍。表现为中枢、周围、自主神经系统异常引起的综合症状。可表现为急性腹痛、腹胀、便秘、恶心、呕吐、肠梗阻、感觉异常、乏力、失眠、焦虑、瞻望、癫痫等。显著的神经内脏症状称为急性发作。原卟啉病发生急性发作及肝病常有诱因,如药物、饮酒、吸烟、饥饿、应激等。EPP还有胆石症、维生素D缺乏、骨质疏松、贫血等临床表现。
根据临床表现,结合家族史、实验室检查、血液/尿液/粪便中的卟啉物质增加和基因分析结果,可明确诊断。须注意的是EPP等原卟啉病,总红细胞原卟啉及不含金属红细胞原卟啉升高,因原卟啉不经肾脏排泄,尿液卟啉水平正常,经过日晒后尿液不呈棕红色。皮肤活检有助于与其他皮肤病鉴别,肝活检可确诊原卟啉性肝病,原卟啉在肝脏沉积的典型表现是偏光显微镜可见特征性的双折射“马耳他十字”。EPP是急性非起泡性皮肤卟啉病,需要与其他光敏性皮肤病鉴别,如日光性皮炎、夏季皮炎、多形性日光疹等。
EPP的管理主要包括:基础防治、急性发作及肝病的防治。基础防治包括:避免日照,需外出活动时建议使用物理防晒及化学防晒,如穿戴防晒衣帽、外涂防晒霜,尽量在避光区域。有研究认为,阿法诺肽、β‐胡萝卜素可增加患者对光照的耐受性,二者被批准用于皮肤卟啉病的治疗。另一项小样本研究发现,西咪替丁可降低患者光敏性,15例患者完成随访,其中11例患者在治疗期间光敏性下降。发生皮肤卟啉病时冰敷及止痛药可缓解疼痛症状。由于缺乏光照,EPP患者常缺乏维生素D,需监测及补充维生素D。急性发作及严重肝病的发生常有诱因,应避免饥饿、吸烟、饮酒、应激,避免服用损伤肝脏药物。急性发作时,予以对症支持治疗,静脉输注氯高铁血红素、碳水化合物负荷治疗可缓解症状。肝功能异常需排除合并其他致病因素,去除可逆因素,予以护肝对症处理,严重的肝损伤的治疗包括:静脉输注氯高铁血红素、血浆置换、熊去氧胆酸,若上述手段仍无法缓解肝功能损伤可考虑肝移植。造血干细胞移植是唯一可治愈EPP并预防肝病复发的手段。
EPP是一种非致命性光敏性疾病,疾病症状多种多样,通过本病例的学习,有助于提升临床医师的诊疗经验,充分认识EPP可表现为皮肤光敏性、腹痛、贫血、肝功能损伤等多种形式,争取早期诊断及进行规范的治疗,改善患者预后。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240323

作者:临床肝胆病杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#肝硬化# #卟啉病#
10