International Journal of Obesity:发胖先胖脑
2021-12-30 自由影像之光 MedSci原创
促进肥胖的遗传机制可能部分是通过大脑中的胰岛素、阿片类药物和内源性大麻素信息系统介导的。
肥胖是全球紧迫的公共卫生问题。迫切需要新的药理学手段来对抗肥胖和伴随的 2 型糖尿病 (T2D) 的增加。尽管完全确定的肥胖与大脑中的神经分子改变和胰岛素抵抗有关,但中枢神经系统中潜在的肥胖促进机制仍然难以确定。
Tatu Kantonen等在International Journal of Obesity杂志发表研究文章,他们研究了脑胰岛素信号传导、μ-阿片受体 (MOR) 和大麻素 CB 1受体 (CB 1 R) 是否与肥胖风险相关。

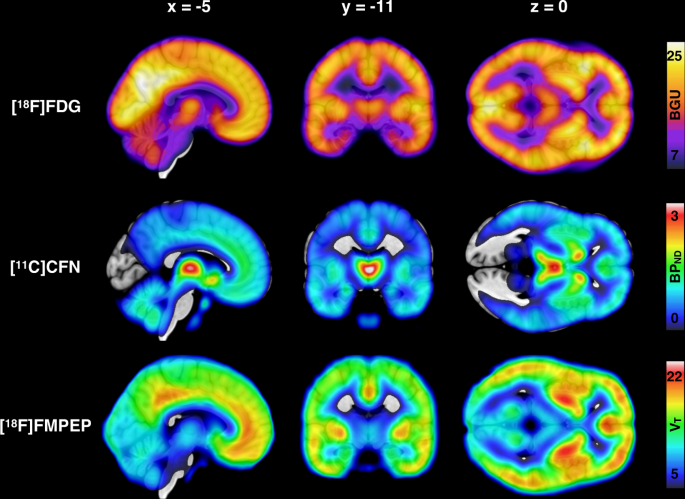
受试者是 41 名具有可变肥胖风险特征的年轻非肥胖男性。肥胖风险通过受试者的体育锻炼习惯、体重指数和家族风险因素进行评估,包括父母肥胖和 T2D。在高胰岛素正常血糖钳夹期间用[ 18 F]FDG量化脑葡萄糖摄取,用[ 11 C]卡芬太尼量化MORs,采用[ 18 F]FMPEP- d 2量化CB 1 Rs。
如何定义家族性肥胖风险呢?研究者基于受试者父母超重/肥胖、2型糖尿病(T2D)的情况进行赋值,区间为0-4。
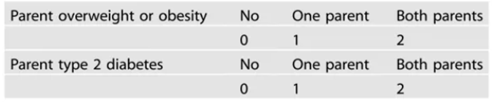
高肥胖风险人群多个脑区(额颞叶、扣带皮层、下丘脑,以及双侧的岛叶和壳核)的大脑葡萄糖摄取明显升高。可见,大脑胰岛素抵抗在肥胖前就已发生。

贝叶斯分层分析显示,家族性肥胖风险与大脑葡萄糖摄取在多个脑区呈强相关。中枢胰岛素抵抗和神经受体信号的改变可能导致食物摄入量增加和体重增长。
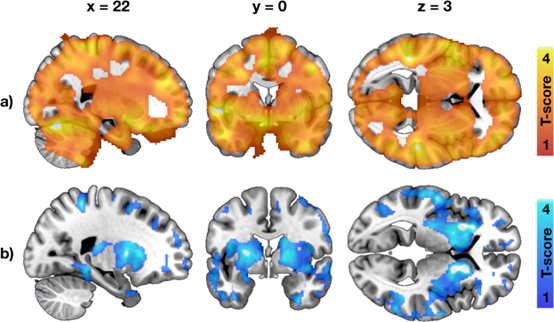
家族肥胖风险对中枢糖摄取和μ-阿片受体可用性的影响。
该研究主要发现是,未来肥胖风险较高的非肥胖年轻男性在胰岛素刺激下的大脑葡萄糖摄取增加。此外,增加的家族肥胖风险(例如,父母肥胖和T2D患病率)与降低μ-阿片类和CB1受体密度以及大脑糖代谢改变有关。在三个PET变量中,脑葡萄糖摄取与家族肥胖风险的相关性最强且最一致。
大脑中的分子和代谢改变也与个人肥胖风险有关。目前的研究结果补充了此前在中年肥胖受试者中报道的结果,表明大脑胰岛素信号和MOR和CB1R神经传递的改变可能会增加体重的风险。
这些结果表明,促进肥胖的遗传机制可能部分是通过大脑中的胰岛素、阿片类药物和内源性大麻素信息系统介导的。
原文出处
Kantonen, T., Pekkarinen, L., Karjalainen, T. et al. Obesity risk is associated with altered cerebral glucose metabolism and decreased μ-opioid and CB1 receptor availability. Int J Obes (2021). https://doi.org/10.1038/s41366-021-00996-y
作者:自由影像之光
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#SIT#
38
#Nat#
39
#eRNA#
45
#Obesity#
47
#ESI#
42