Lecanemab治疗AD获FDA完全批准上市
2023-07-07 MedSci原创 MedSci原创
Lecanemab最初由卫材和BioArctic联合开发,它与β淀粉样蛋白的可溶性寡聚体特异性结合。在AD患者大脑中,β淀粉样蛋白的水平升高会促使它们从单体聚集成为二聚体和可溶性寡
Lecanemab最初由卫材和BioArctic联合开发,它与β淀粉样蛋白的可溶性寡聚体特异性结合。在AD患者大脑中,β淀粉样蛋白的水平升高会促使它们从单体聚集成为二聚体和可溶性寡聚体,最终进一步聚集成为大脑中的淀粉样蛋白沉积。以前的科学研究显示,β淀粉样蛋白的可溶性寡聚体表现出比单体更强的细胞毒性。Lecanemab通过与它们结合,可中和并清除具有毒性的可溶性寡聚体。
今年1月,FDA基于lecanemab降低患者大脑淀粉样蛋白沉积的效果,加速批准它的上市申请,用于治疗阿尔茨海默病。基于加速批准通道获批上市的新药需要进行验证性临床试验,确认它们的临床疗效。一个月前,在美国FDA召开的咨询会议中,与会专家以6:0一致性的投票结果,认为3期临床试验CLARITY AD的试验结果支持Leqembi的完全批准。
在3期临床试验中,lecanemab与安慰剂组相比,显著降低了试验主要终点CDR-SB的增加速度(CDR-SB评分越高意味着患者临床功能越低)。在第79周时与安慰剂组相比,平均CDR-SB评分的变化降低27%。FDA认为CDR-SB是有效评估患者认知能力和日常功能的综合指标。CDR-SB的统计显著变化具有临床意义。
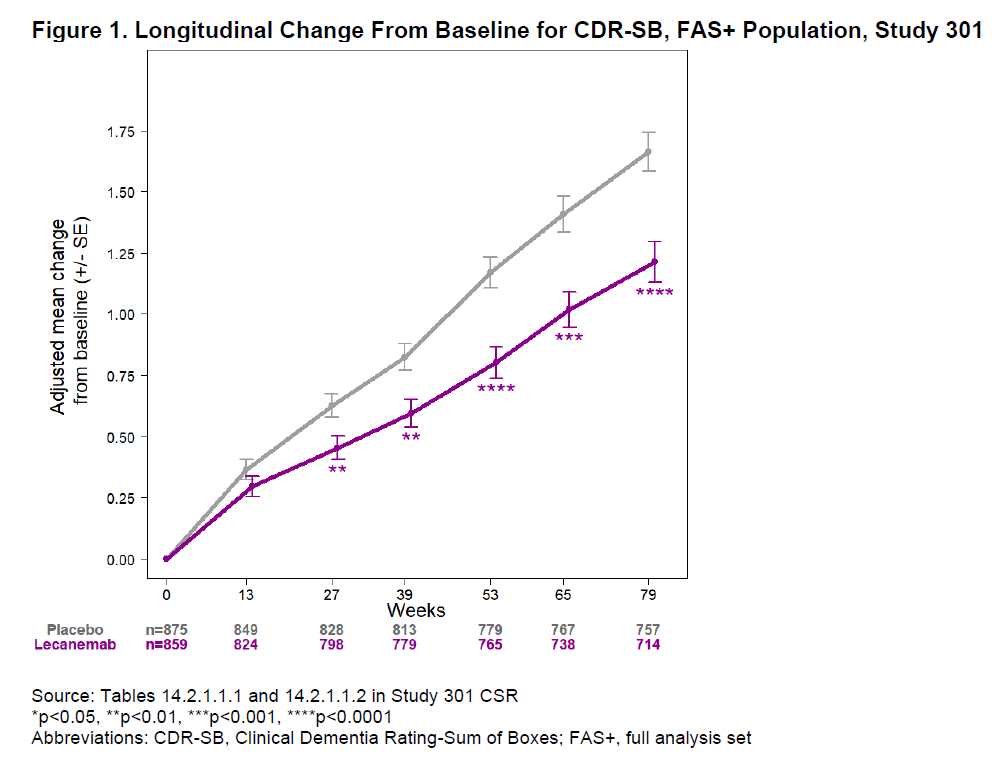
Lecanemab显著降低CDR-SB评分的增加速度(图片来源:FDA官网)
此外,主要终点CDR-SB评分的改变也得到多个次要终点一致性改善的支持,包括独立评估认知能力的ADAS-Cog 14评分以及评估日常活动的ADCS-ADL-MCI评分。FDA指出,这两个临床终点在其它研究中曾被作为共同主要终点。这些临床终点的显著区别进一步支持CDR-SB评分改善具有临床意义。
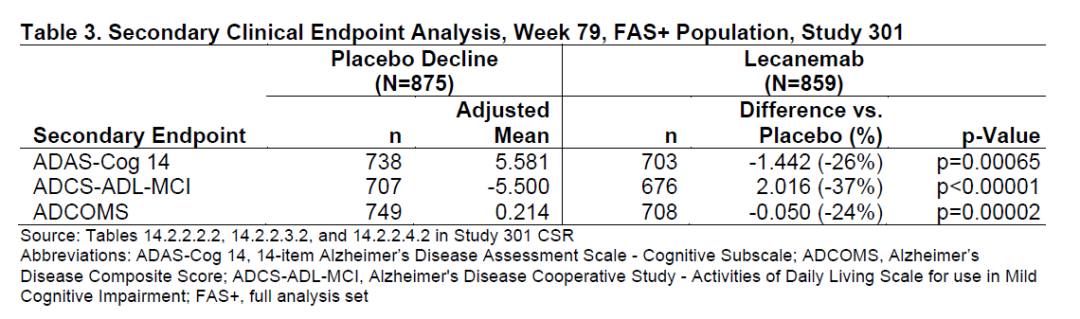
Lecanemab显著改善多个次要终点指标(图片来源:FDA官网)
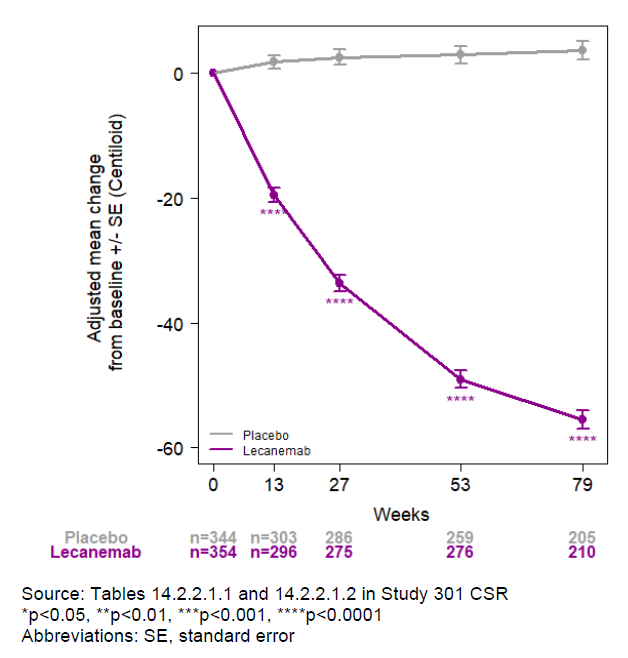
此外,在这项研究中,生物标志物研究显示患者大脑的淀粉样蛋白沉积随着时间推移显著降低,反映了lecanemab与靶点产生相互作用,并且影响下游tau蛋白的病理学和神经退行性病变。这些证据也支持lecanemab的临床获益。
在安全性方面,主要值得关注的不良事件为淀粉样蛋白相关的成像异常(ARIA)。在这项研究的随机双盲阶段,lecanemab组接受治疗30天内患者出现ARIA的比例为21%,安慰剂组为9%。具体数据请见下表:
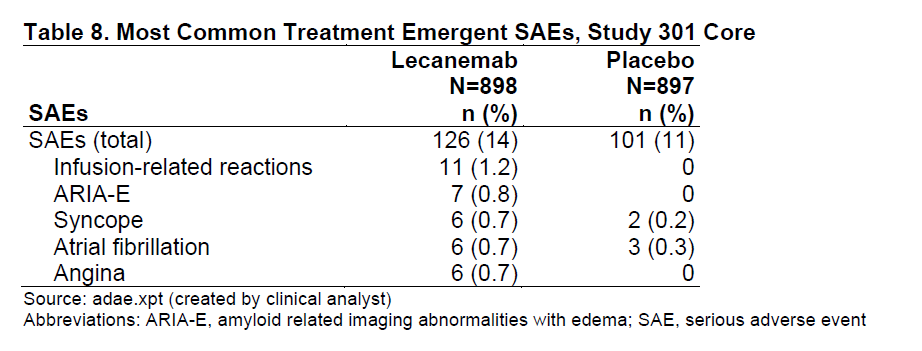
淀粉样蛋白相关的成像异常事件统计(图片来源:FDA官网)
大多数ARIA病例并没有表现出症状,出现症状的ARIA患者在lecanemab组中的比例为3.2%,安慰剂组为0.2%。ARIA最常见的症状为头痛、其它症状包括眩晕、恶心、视觉变化,迷惑等。其它安全性信号包括大脑出血、输注相关反应。ARIA与APOE4基因有关,在带有两份基因拷贝数的患者中产生ARIA的风险增加。
虽然在lecanemab组出现两例因为大脑出血导致的死亡和一例与潜在脑血管事件和严重ARIA相关的死亡,但是由于其它合并症(例如脑内淀粉样血管病,CAA),以及其它同时所接受疗法的影响,难于确认lecanemab在这些死亡中的确切作用。目前lecanemab的处方标签和患者用药指南包括对高风险患者的使用警告,并建议增加对像头痛这类警讯的监测和观察。然而,FDA不认为这些潜在严重甚至致命的脑出血风险足够高到排除这类患者使用lecanemab。FDA表示,像CAA这样的病症在阿尔茨海默病患者中相对常见,因此,目前将lecanemab与这类安全风险联系在一起仍为时过早。不过在FDA报告后的问答环节中,一些小组成员的评论暗示他们更倾向lecanemab应有更严格的标签或限制,以进一步保护那些具潜在高风险产生严重脑出血的患者。
FDA药品评估和研究中心神经科学办公室的代理主任Teresa Buracchio博士表示这是一款靶向阿尔茨海默病基础病理进程的药物首次在这一疾病中表现出临床收益。“这个验证性研究确认,对阿尔茨海默病患者来说,这是一种安全有效的治疗方法。”
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言