3期临床结果优秀,可治疗“失明”的基因疗法或将上市
2016-08-13 佚名 BioArt
今天,总部设在美国费城,致力于基因治疗的创新生物技术公司Spark Therapeutics公布了其领先候选产品 voretigene neparvovec(以前被称为SPK-RPE65)的3期临床试验的延续新数据。此前 voretigene neparvovec 已经收到了美国FDA的突破性疗法和孤儿药资格认证,正在被开发作为由RPE65基因突变引起的遗传性视网膜疾病(IRD)的潜在治疗方案。▲
今天,总部设在美国费城,致力于基因治疗的创新生物技术公司Spark Therapeutics公布了其领先候选产品 voretigene neparvovec(以前被称为SPK-RPE65)的3期临床试验的延续新数据。此前 voretigene neparvovec 已经收到了美国FDA的突破性疗法和孤儿药资格认证,正在被开发作为由RPE65基因突变引起的遗传性视网膜疾病(IRD)的潜在治疗方案。
▲Spark致力于严重遗传性疾病治疗(图片来源:Spark官网)
IRD是一种致盲性罕见遗传病,由基因RPE65功能丧失所引起。RPE65基因突变患者的视网膜感光细胞(色素细胞)会逐渐失去功能并坏死,最终导致视觉功能的完全丧失。
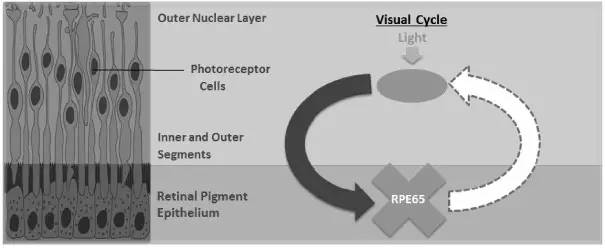
▲RPE65基因突变导致失明(图片来源:UNITED STATES SECURITIES AND EXCHANGE COMMISSION 官网)
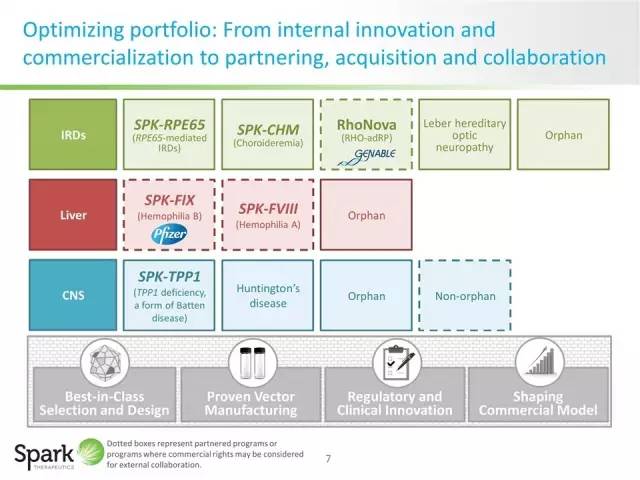
Spark Therapeutics成立于2013年,其先进的基因治疗平台正在被应用于一系列有关严重遗传性疾病治疗的临床前和临床研究项目中,包括上述遗传性视网膜疾病,以及血液系统疾病和神经退行性疾病等。Spark的研究人员应用腺相关病毒(AAV)或非致病感冒病毒为载体,将RPE65序列编码入病毒载体,再注射到患者视网膜内得以蛋白表达,这样便有望促进视网膜感光细胞的存活和功能,有效将光信号转换成电信号,最终患者的眼睛可以恢复视觉感光。
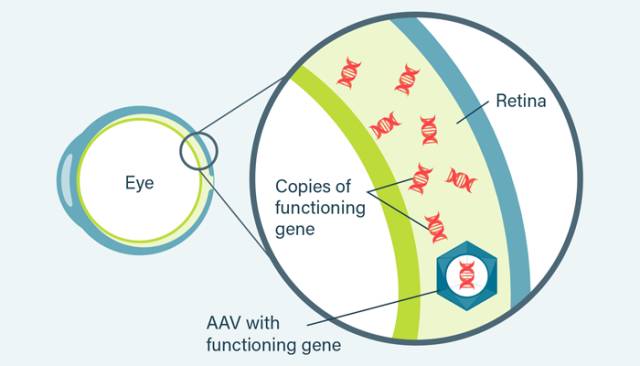
▲基因治疗IRD的原理(图片来源:wonderbaby.org 官网)
在这项关键性的多中心、随机、对照组3期临床试验中,经voretigene neparvovec治疗后一年,93%(27/29)的患者功能性视力有所改善,并且基因治疗的疗效长达两年之久。同时,voretigene neparvovec被证明安全,没有严重不良事件。

▲Spark多样化的研发线(图片来源:Spark官网)
Spark Therapeutics的总裁兼首席科学官Katherine High博士说道:“我们现在搜集了voretigene neparvovec给药后的更多数据,并且很高兴看到高达93%的受试者的功能性视力有显着提高。我们将继续临床试验数据的分析,以便进一步阐明voretigene neparvovec对RPE65介导的遗传性视网膜病患者的潜在持久效益。”(生物谷Bioon.com)
参考资料:
[1] Spark Therapeutics Announces New Positive Data from Continuation of Phase 3 Trial of Voretigene Neparvovec
[2] Spark Therapeutics (ONCE) Touts Long-Term Positive Phase III Gene Therapy Data
[3] Spark Therapeutics官方网站
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#临床结果#
38
#3期临床#
0
关注值得学习。赞!好文有待探究。
53
低调做事
46
学习到了
54