Nat Immunol:美国哈佛医学院/北京大学合作揭示了早期肿瘤发生过程中基因编辑的全基因组!
2024-08-23 iNature iNature
该研究表明肿瘤编辑抑制先天和适应性抗肿瘤免疫,并通过抑制DNA甲基化而逆转。
癌细胞编辑基因表达以逃避免疫监视。然而,缺乏早期肿瘤发生过程中基因编辑的全基因组研究。
2024年8月21日, 美国哈佛医学院Judy Lieberman、Winston Hide、北京大学张莹共同通讯在Nature Immunology在线发表题为”Tumor editing suppresses innate and adaptive antitumor immunity and is reversed by inhibiting DNA methylation“的研究论文,该研究表明肿瘤编辑抑制先天和适应性抗肿瘤免疫,并通过抑制DNA甲基化而逆转。
在这里,研究人员在乳腺癌基因工程小鼠模型(GEMM)中使用单细胞RNA测序来无偏倚地识别编辑过的基因。晚期肿瘤抑制抗肿瘤免疫基因,减少浸润性免疫细胞和肿瘤免疫细胞间的通讯。在下调肿瘤基因列表中,主要是先天免疫基因,尤其是干扰素刺激基因,而调节细胞内在恶性肿瘤的基因大多未被编辑。早期肿瘤中的初始和活化的CD8+ T细胞在晚期肿瘤中被耗尽或前体耗尽的细胞所取代。低剂量地西他滨可通过抑制DNA甲基化逆转免疫基因的抑制,从而抑制肿瘤生长并恢复免疫控制,增加肿瘤浸润淋巴细胞的数量、功能和记忆,减少髓系抑制细胞的数量。地西他滨诱导了GEMM、植入性乳腺和黑色素瘤中重要的干扰素、焦亡和坏死基因、炎症细胞死亡和免疫控制。

免疫治疗的临床成功清楚地表明免疫细胞可以控制肿瘤的生长。然而,大多数实体癌对目前的免疫疗法没有反应。虽然免疫监视限制和消除了一些新形成的免疫原性肿瘤,但生长引起疾病的肿瘤迅速进化抵抗免疫监视和逃避免疫控制。肿瘤编辑它们的基因表达以避免免疫识别和清除。编辑可以通过基因突变、扩增、删除和/或基因表达的表观遗传修饰来实现。免疫逃避肿瘤克隆还可以通过塑造肿瘤微环境(tumor microenvironment, TME)来抑制细胞毒性淋巴细胞功能,进一步促进免疫逃避。
以前的免疫编辑研究主要检查激活抗肿瘤T细胞的基因和/或途径。抗原加工和递呈的下调、检查点受体配体、免疫抑制细胞因子和“不要吃我”信号的上调、TME免疫细胞的募集和排斥不良以及免疫抑制TME是已知的肿瘤免疫逃避策略。肿瘤抗原在免疫正常而非免疫缺陷小鼠的肿瘤发育过程中发生突变和表观遗传沉默,表明免疫选择利用遗传和表观遗传机制来降低肿瘤的免疫反应性。
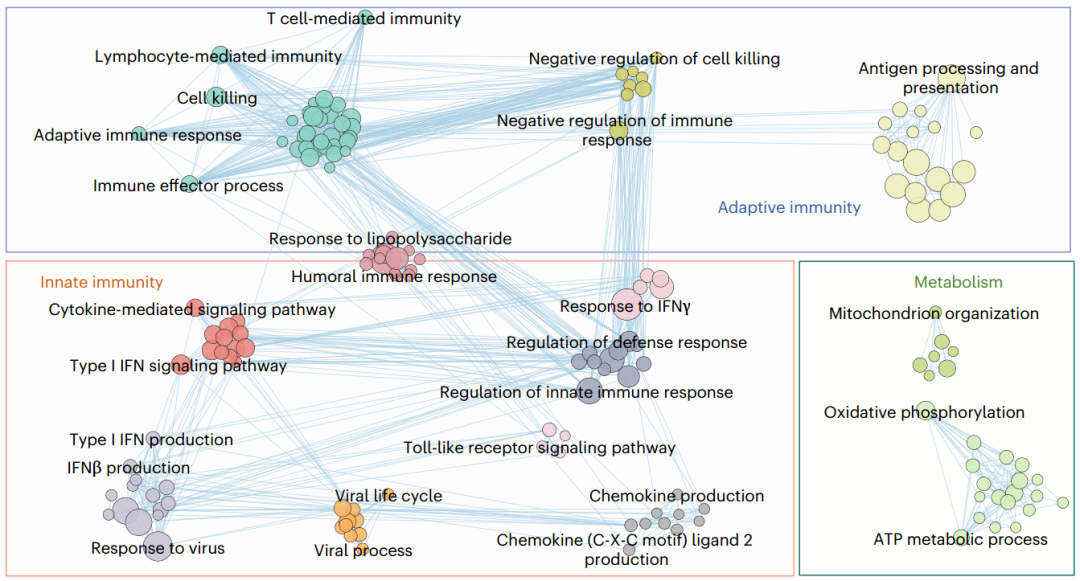
晚期和早期肿瘤中与下调基因相关的显著GO的相互作用网络(图源自Nature Immunology )
T细胞效应功能和记忆的刺激依赖于激活先天免疫的危险信号,将免疫细胞招募到危险地点,并允许免疫细胞区分自我和非自我,或者对于肿瘤来说,正常细胞来自于转化的细胞。如果没有危险信号,淋巴细胞很快就会对肿瘤产生耐受。DNA启动子超甲基化抑制先天性免疫干扰素(IFN)、坏死和焦亡信号通路,这些信号在一些癌症中已经被描述。由于新发肿瘤难以检测,因此尚未对早期肿瘤发生过程中基因表达变化进行全基因组研究。肿瘤基因编辑在多大程度上涉及抑制免疫基因与促进内在细胞恶性肿瘤的基因,目前尚不清楚。
在这里,作者利用诱导MMTV驱动Erbb2Δ16癌基因产生的侵袭性乳腺癌GEMM来无偏倚地识别在早期肿瘤发生过程中被抑制的基因表达。单细胞RNA测序(scRNA-seq)比较癌基因诱导后1周的早期GEMM肿瘤与1个月后形成的肿瘤,发现大多数被抑制的基因参与免疫信号传导,特别是先天免疫,包括IFN和IFN刺激基因(ISGs)。该研究表明,免疫编辑主要依赖于表观遗传调节,因为在免疫编辑过程中被抑制的基因和那些被低剂量DAC抑制的基因重叠,抑制DNMTs可以恢复免疫控制。一致地,DAC增加了DNA去甲基化和免疫基因的染色质可及性。该研究揭示了TIL在肿瘤发生早期如何改变其表型、基因表达、功能以及与肿瘤细胞的相互作用。T细胞衰竭发生迅速,在癌基因诱导后1个月内发生。
参考消息:
https://www.nature.com/articles/s41590-024-01932-8
作者:iNature
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#基因编辑# #肿瘤免疫#
89