山东大学倪石磊/姜新义/徐峰等《AM》:可降解载药微针用于抑制胶质母细胞瘤术后复发
2024-09-05 BioMed科技 BioMed科技
该研究报道了一种可植入术腔的微针,通过激活肿瘤相关巨噬细胞引发抗肿瘤免疫,解决GBM术后局部复发问题。
胶质母细胞瘤(GBM)是一种高度恶性的侵袭性脑肿瘤,由于其浸润性生长,肿瘤与正常脑组织边界不清,难以通过手术彻底切除。超过90%的GBM患者会在手术切缘2-3厘米范围内复发,严重影响患者预后,导致术后5年生存率不足8%。因此,如何克服术后复发是GBM临床治疗中的关键问题。
山东大学齐鲁医院倪石磊团队联合山东大学姜新义团队、山东大学齐鲁医院徐峰团队在期刊Advanced Materials上发表了题为“Implantable Microneedle-Mediated Eradication of Postoperative Tumor Foci Mitigates Glioblastoma Relapse”的研究成果。山东大学齐鲁医院张玉霖、房泽正、刘泽娟为本文的共同第一作者。该研究报道了一种可植入术腔的微针,通过激活肿瘤相关巨噬细胞引发抗肿瘤免疫,解决GBM术后局部复发问题。

巨噬细胞是人体固有免疫系统的重要组成部分,在肿瘤微环境中发挥关键作用。在GBM复发过程中,大量巨噬细胞被募集至肿瘤局部,致使肿瘤相关巨噬细胞成为GBM内含量最丰富的抗原提呈细胞,约占肿瘤瘤体内细胞总数的30-50%。然而,肿瘤局部的免疫抑制微环境导致被募集的巨噬细胞呈现出促进肿瘤增殖的M2表型,使得巨噬细胞无法有效识别、吞噬肿瘤细胞并完成抗原呈递,导致机体无法产生有效的适应性免疫反应。此外,由于抗原提呈细胞失能, DC、T细胞、NK细胞等难以浸润至肿瘤组织,进一步促进了GBM术后局部复发。
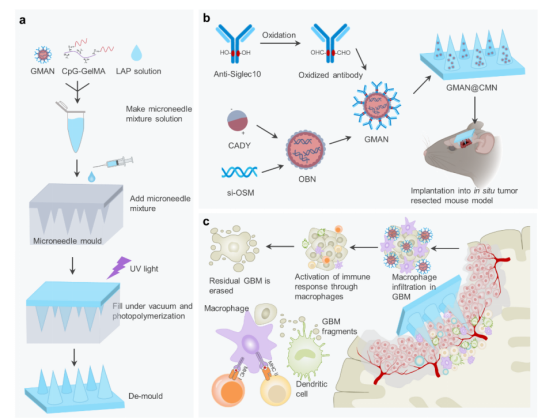
在这项研究中,研究团队通过合成巨噬细胞激活纳米颗粒(GMAN)阻断CD24-Siglec10“别吃我”信号通路,有效促进了巨噬细胞对肿瘤细胞的识别和吞噬。同时,联合抑制巨噬细胞表达抑瘤素M (Oncostatin M, OSM),实现了逆转肿瘤术后局部的免疫抑制微环境。为实现颅内应用,该团队进一步合成了生物可降解微针,通过偶联免疫佐剂CpG寡核苷酸,达到了募集免疫细胞抵达局部以产生抗肿瘤免疫反应的效果。最终,通过在术腔壁贴附该免疫激活微针实现了抑制GBM术后局部复发的目的。
这项研究通过颅内可植入微针,高效地在局部递送纳米药物,为局部高复发的恶性肿瘤提供了新的治疗理念。此外,该研究也为该类型肿瘤治疗提供了基于激活固有免疫克服肿瘤局部免疫抑制策略的实践指导。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202409857
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#胶质母细胞瘤# #侵袭性脑肿瘤#
22