综述|纳米材料在鼻脑通路治疗胶质母细胞瘤研究进展
2024-08-19 中国神经精神疾病杂志 中国神经精神疾病杂志
鼻脑通路递送结合纳米技术呈现广泛应用前景,为GBM治疗带来新突破。
摘 要 胶质母细胞瘤(glioblastoma,GBM)是最致命的肿瘤之一,由于血脑屏障(blood-brain barrier,BBB)的存在,其药物治疗受到了严重限制。鼻脑通路递药作为一种通过鼻内途径输送药物至中枢神经系统(central nervous system,CNS)的给药方式,可以避开BBB直接靶向脑部。鼻腔分为前庭区、嗅觉区和呼吸区。纳米药物可以通过嗅觉区的嗅神经通路和呼吸区的三叉神经通路实现高效运输到CNS。近年来,纳米递药平台在经鼻给药治疗GBM的研究中得到广泛关注,主要涉及聚合物、脂质体、无机金属纳米颗粒等方式。这些技术的发展为克服BBB、提高药物传递效率以及改善GBM患者预后提供了新的思路和选择。
关键词
胶质母细胞瘤;鼻脑通路;聚合物;脂质体;无机金属纳米材料
胶质母细胞瘤(glioblastoma multiforme,gbm)是中枢神经系统(central nervous system,CNS)中最常见的原发性肿瘤之一,恶性程度高、异质性高[1-2]。传统治疗方法包括手术、放疗和替莫唑胺化疗,但受制于血脑屏障(blood-brain barrier,BBB),药物进入脑部效果有限[3-4]。鼻脑通路递送是一种创新的治疗方式,通过鼻腔直接输送药物到脑部,无需穿过BBB[5]。这种方法具有多重优势,如提高生物利用度、快速起效和非侵入性[6-7]。近年来,纳米技术的发展引人瞩目。纳米载体通过提高药物的稳定性和溶解度,有效增强了药物的利用率[8-9]。各种类型的纳米载体被设计用于提高药物在鼻腔中的吸收效率[10-11]。鼻脑通路递送结合纳米技术呈现广泛应用前景,为GBM治疗带来新突破。
1 鼻的解剖、生理特点及经鼻给药的通路机制
鼻是人体内最小而复杂的器官之一,具有独特的解剖结构和生理特点,在呼吸、嗅觉和药物输送等方面发挥着重要作用。鼻腔总表面积约为160 cm2、体积为13 mL,鼻孔到鼻咽长度为12~14 cm[12-13]。鼻腔内部由鼻中隔分为两个腔,每个腔又分为前庭区、嗅觉区和呼吸区[14-15]。
药物通过鼻腔进入大脑的途径可分为直接途径(嗅神经通路和三叉神经通路)和间接途径(系统通路)[14]。直接途径允许药物通过嗅觉区的嗅觉神经或呼吸区的三叉神经直接进入大脑。嗅觉神经通路是最短、最直接的路线[16],嗅觉区具有高密度的血管和高渗透性,有利于药物的迅速吸收和转运[17]。间接途径则是药物从呼吸区吸收到血液循环再到达脑部,是连接CNS的非直接途径,涉及多种生物屏障,例如BBB[18]。
前庭位于鼻腔前部,是抵御病原体侵入的第一道屏障。由于前庭区域表面积小、缺乏脉管系统,仅由覆盖的鳞状上皮提供保护,但渗透性相对较差,因此较少用于药物输送[16]。
嗅觉区位于鼻腔上部,直接连接大脑。其中,嗅觉上皮由基底细胞、支持细胞和嗅觉受体神经元组成,后者负责连接鼻腔和嗅球,形成独特的嗅觉通路[19]。筛板是支持这一通路的骨结构,通过带有神经束的小孔允许药物从嗅上皮进入CNS,是药物经嗅球进入CNS的直接通道。药物在嗅觉神经通路中可能经历细胞内运输和细胞外运输过程。细胞内运输是指药物在嗅觉神经元内吞作用的内化过程。之后,药物沿着神经元的轴突运输到达嗅球,在那里通过胞吐作用释放到大脑的不同区域[20]。这种神经元内转运被认为是一种缓慢的转运机制,需要耗费数小时到数天[12]。相反,细胞外运输是迅速的。细胞外通路始于药物穿过鼻上皮到达固有层,通过跨支持细胞或随支持细胞旁穿过嗅觉黏膜,然后沿着神经元轴突和血管的周围继续输送。在1.5~6 h内,药物可到达嗅球和CNS,完成传递[21]。因此,细胞外转运被认为是药物快速转运到大脑的主要机制。
呼吸区是鼻腔中最大的区域,表面积约为130 cm2,具有丰富的血管和高渗透性,适合药物吸收。三叉神经是脑神经中最大的一束神经,分为眼、上颌、下颌三个分支,药物可通过其上颌支和眼支直接进入大脑,连接大脑的尾部,如脑桥和延髓[22-23]。与嗅觉途径一样,药物可以通过三叉神经在细胞内或细胞外运输。这一通路可能涉及细胞内的轴突运输或内吞作用。三叉神经细胞外通路的药物运输也涉及多种机制,包括细胞旁转运、跨细胞转运、载体介导转运、细胞转运和受体介导转运[12-24]。
药物经鼻脑通路传递的机制是一个复杂的过程,嗅觉神经和三叉神经在其中发挥着重要作用。嗅觉神经和三叉神经的神经周围和血管周围区域是鼻内给药过程的主要贡献者。这些机制的深入研究有助于更好地设计和优化鼻腔给药方案,提高药物的生物利用度和治疗效果。
2 纳米材料在鼻脑通路治疗GBM的应用
纳米材料在鼻脑通路治疗GBM方面显示出巨大的潜力,通过采用各种纳米载体,包括聚合物、脂质体和金属纳米材料,研究人员已经取得了显著的进展(图1)。这些纳米材料具有可调控的大小、表面性质和载药能力等独特优势。
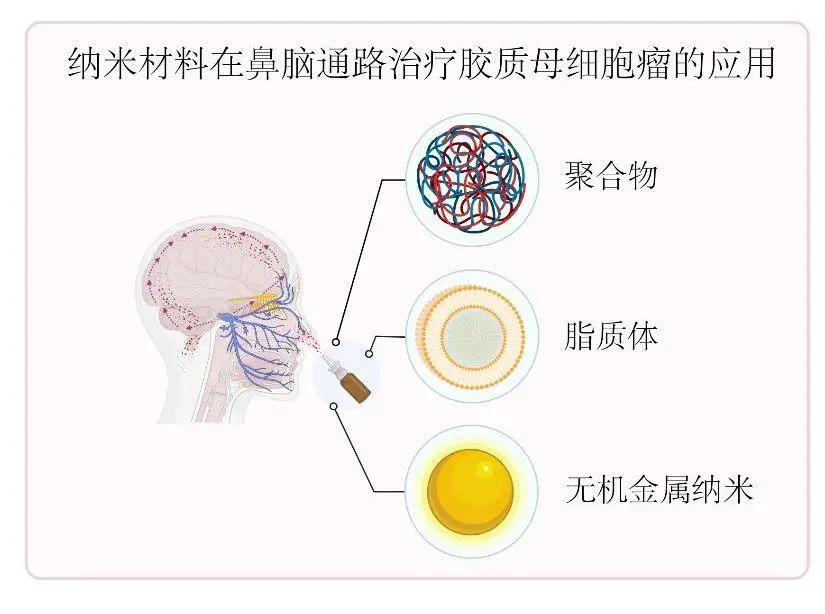
图1 纳米材料在鼻脑通路治疗GBM的示意图Fig.1 Schematic diagram of nanomaterials in the Nose-to-Brain pathway for glioblastoma treatment
2.1 聚合物
聚合物拥有高度的可设计性和合成的灵活性,作为药物载体具有良好的药物包封能力和生物安全性。在鼻腔给药过程中,由于其设计组成和结构特征,可有效减少黏液纤毛运动,从而延长其在鼻黏膜中的停留时间,并通过短暂打开紧密连接来增加鼻上皮细胞旁渗透性[25-26]。
壳聚糖是一种可生物降解和生物相容性的聚合物,基于β-(1-4)-连接的D -氨基葡萄糖和N -乙酰- D -氨基葡萄糖亚基,通过糖苷键连接,在生理pH值下带正电荷,允许带负电荷的分子如小干扰RNA(small interfering RNA,siRNA)的高负载。这种有趣的赋形剂具有粘附性和增强渗透性,是进一步增强鼻到脑运输的理想选择[27]。有研究采用壳聚糖纳米颗粒进行鼻内给药,以实现siRNA的有效递送到CNS肿瘤(如GBM)[28]。实验结果表明,这种壳聚糖纳米颗粒在鼻内给药后能够快速扩散到鼻黏膜,进而到达嗅球和后脑,展现出良好的渗透性和分布性。此外,通过纳米颗粒载入的抗Gal-1 siRNA在肿瘤内显示出选择性分布,导致肿瘤中Gal-1的减少。这项研究结果强调了通过鼻内途径传递生物活性药物到CNS肿瘤的可行性,为聚合物在药物输送领域的应用提供了有力的示例。肿瘤免疫疗法作为新兴的治疗方法,利用患者自身免疫系统来对抗肿瘤[29],有望进一步提GBM患者的生存率[30]。CpG ODN是一种Toll样受体9激动剂,可以增强免疫原性,在癌症免疫治疗领域的临床试验和临床前研究中被广泛应用作为免疫佐剂。WEI团队研究报道了利用聚合物经鼻脑通路靶向递送CpG,显著增强小鼠GBM的免疫治疗效果[31]。CpG被有效地装载在载脂蛋白E肽引导的聚合体中,形成能够靶向脑部、定位到胶质瘤和颈淋巴结的纳米免疫佐剂,在体内强烈促进树突状细胞的成熟、抗原交叉呈递以及促炎细胞因子的产生。这种经鼻脑通路递送的智能纳米免疫佐剂为GBM的免疫治疗提供了一种创新、无创且高效的策略。
聚乳酸-羟基乙酸共聚物[poly (lactic-co-glycolic acid) ,PLGA]具有许多有益的特性,包括无毒性、生物相容性以及优异的生物降解性。它不仅能够防止药物水解和酶降解,还能够降低聚合物外壳对组织的刺激和免疫刺激作用,大大提高治疗效果和效率[32]。AHMAD等[33]使用了壳聚糖包被的PLGA纳米颗粒,通过细胞穿透肽DP7-C修饰透明质酸的纳米粒(HA/DP7-C),形成多功能核壳结构的纳米粒HA/DP7-C。通过这一设计,研究者成功提高了药物在鼻至脑递送中的效率。携带卡莫司汀的PLGA纳米颗粒在经鼻给药后脑血浆浓度分别是经鼻腔给卡莫司汀混悬液和静脉注射卡莫司汀的2.8倍和14.7倍。此外,HA/DP7-C治疗策略展现了较低的细胞毒性和较高的细胞摄取效率。在体内实验中,这种纳米胶束通过三叉神经通路成功将siRNA传递到CNS,表现出对GBM优异的治疗效果。另一项研究中,SOUSA等[34]利用聚(D, l -乳酸-羟基乙酸)纳米颗粒成功地将贝伐单抗送达到大脑,以应对传统治疗GBM的局限性。这种纳米颗粒通过鼻内给药途径,巧妙地绕过了BBB,采用嗅觉和三叉神经通路,直接将药物输送到CNS,实现了更高的脑生物利用度。与鼻内给药游离贝伐单抗相比,PLGA纳米颗粒不仅提高了贝伐单抗在脑内的渗透和停留时间,还表现出更强的抗血管生成作用,有效减缓了肿瘤的生长。
2.2 脂质体
脂质纳米颗粒在鼻脑运输中具有显著的应用潜力。通过将药物包封在这些纳米颗粒中,不仅有效防止了酶降解和外排运输机制的影响,提高了药物的稳定性和溶解度,还通过缓释效果延长了药物在鼻腔的停留时间[24]。这种保护机制维持了药物的活性,加速了药物通过嗅觉神经元的运输,使其更高浓度和更高效地到达大脑。通过添加生物黏附赋形剂和调节剂,脂质纳米颗粒在鼻黏膜内停留时间得到提高,从而改善了药物通过嗅觉神经元的运输效率,增加了药物在CNS的靶向性。
HU等[35]通过将特定siRNA(sic-Myc)用八精氨酸预压缩并封装在含有选定肽89WP修饰的脂质体中,形成具有稳定核壳结构的89WP- CLS/R8/siRNA。研究表明,这种脂质体在鼻给药后能够通过巨噬作用被GBM细胞优先内化,避免被溶酶体捕获。通过这种细胞摄取途径,脂质体能够在短时间内释放siRNA到细胞质中,有效下调GBM细胞的c-Myc 信使RNA和蛋白表达水平。修饰的脂质体在GBM中的脑分布显著增加,显示了这一治疗策略的潜在效果。MICHELS等[36]研究介绍了一种新型的脂质纳米乳剂,其中包含热响应聚合物(poloxam407),通过鼻腔给药来提高替莫唑胺向大脑释放的效率。实验结果显示,相较于对照组,该纳米乳剂在大鼠脑内实现了显著增加替莫唑胺含量,最终导致肿瘤体积减小,呈现了显著的抗肿瘤效果。
2.3 无机金属纳米材料
无机金属纳米材料在鼻脑通路中的应用展示了潜在的治疗和影像学优势。这种应用不仅拓展了药物递送的可能性,还为治疗GBM提供了前所未有的工具和视角[37]。这为未来的研究和临床治疗打开了新的方向,有望带来更加精准、高效的治疗手段。
SUKUMAR等[38]研究利用金氧化铁纳米颗粒作为载体,通过鼻到脑直接运输途径绕过BBB,实现了对GBM 的治疗性多模态联合显像和增敏替莫唑胺。这种纳米材料表面负载了治疗性非编码RNA (miR-100和antimiR-21),外面包被β-环糊精-壳聚糖杂化聚合物,修饰细胞靶向肽T7,通过鼻内给药方式将其定向递送到小鼠的GBM中[38]。研究结果显示,这种无机金属纳米材料能够有效积累于体内,为提高GBM细胞对替莫唑胺的敏感性提供潜在机制,并通过多模态分子和解剖成像实现了对纳米颗粒的递送、运输和治疗效果的全面监测。
免疫原性化疗可以诱导损伤相关分子模式(damage associated molecular patterns,DAMPs)的释放和I型干扰素(interferon-I,IFN-I)的产生,导致免疫原性细胞死亡(immunogenic cell death,ICD)[39]。在这个过程中,ICD将肿瘤细胞转化为原位疫苗,进而激活抗肿瘤免疫反应[40]。有研究构建了一种新型寡核苷酸纳米制剂,通过静电相互作用将金纳米颗粒与聚肌苷酸-聚胞苷酸结合[41]。聚肌苷酸-聚胞苷酸是一种人工合成的双链RNA,能够结合细胞内的Toll样受体-3和视黄酸诱导基因I类受体,产生IFN-I。联合使用寡核苷酸纳米制剂和TMZ显著改善了荷瘤小鼠的总体生存率。通过RNA测序和免疫组化分析,显示该纳米制剂联合TMZ组能够有效诱导ICD,激活免疫反应,并引发T淋巴细胞的浸润,从而高效抑制GBM的生长。
金纳米棒由于其高长宽比而具有独特的光学和生物学特性,成为潜在的CNS治疗药物传递平台。研究采用了荧光染料和金属螯合剂功能化的金纳米棒,通过PEG间隔剂与铟-111配合,用于光学和核成像[42]。鼻内给药后,观察到小鼠脑部对金纳米棒的快速摄取,尤其是在给药后1 h内,经嗅球进入脑部,然后扩散到其他区域。这项研究验证了金纳米棒作为鼻到脑药物递送载体的潜力,为治疗GBM提供了新的可能性。
KOU等[43]制备了一种荧光染料标记的聚乙二醇化Fe3O4纳米颗粒,旨在研究鼻内给药纳米药物的传递途径。在经过鼻给药后,Fe3O4纳米颗粒首先通过鼻黏膜进入三叉神经和嗅神经的神经周间隙。随后,它们与脑脊液一起流入蛛网膜下腔。一旦进入蛛网膜下腔,Fe3O4纳米颗粒将随着脑脊液的循环到达整个脑池,最终进入脑实质。这一研究结果表明,通过这种方式,Fe3O4纳米颗粒成功地经过鼻给药途径将药物递送到大脑。
不同类型的纳米载体展现出多样性的应用潜力。聚合物可提高药物的溶解度、稳定性,并通过调节表面性质实现对鼻黏膜的精准靶向。脂质体则具有可调控的释放动力学,可以实现长效和持续的药物释放。金属纳米材料则通过其独特的光学和生物学性质,为多模态成像和治疗联合提供了可能性。
3 展望
纳米材料在鼻脑通路中的应用虽然充满前景,但仍面临一些挑战和不足之处。黏液纤毛清除系统对鼻脑通路的影响显著。该系统通过减少药物在鼻腔中的停留时间,药物的半衰期仅为15~20 min,降低了药物在人鼻腔中的生物利用度[11]。对于吸收速度较慢的分子,如亲水性分子和多肽,由于与黏膜的接触时间短,药物的吸收和穿透性明显降低。黏液纤毛清除系统的存在使得经鼻给药的药物输送受到了挑战,因此需要有效的策略和技术以提高药物的生物利用度和鼻脑通路的递送效果。
鼻腔体积的限制仅允许注射少量液体,这限制了纳米材料在鼻脑通路中的药物输送量[44]。未来需要研发更为高效的纳米制剂来克服这一限制。另外,鼻腔内的生理结构和药物吸收特性在不同区域存在差异,不同部位会影响纳米材料在鼻脑通路中的应用效果。滴鼻装置的位置对于穿透鼻黏膜和提高输送效率至关重要。在鼻腔的适宜位置递送,如鼻腔的上部和后部,可以改善并增强药物的吸收[45]。
在后续的发展与展望中需要多学科研究,进一步深化纳米药物输送系统的设计,包括材料科学、药学、生物学等领域的协同合作。目前大部分的研究还处于实验室的前临床阶段,未来需要更多的临床研究验证纳米材料在鼻脑通路中的应用效果和安全性。对CNS各区域的生物学和药物递送机制的深入了解将为纳米材料在鼻脑通路中的应用提供更精准的方向;同时随着对疾病的分子机制和肿瘤异质性的认识进一步加深,未来有望实现对纳米药物输送系统的定制化,以满足不同疾病和患者的个性化治疗需求。尽管存在挑战,通过综合研究和创新,纳米药物的鼻脑通路输送系统有望成为治疗GBM的有效策略。
参考文献:
1. LOUIS D N, PERRY A, WESSELING P, et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary[J]. Neuro Oncol, 2021, 23(8): 1231-1251.
2. 阴鲁鑫, 徐义强, 肖维汉, 等. 成人胶质母细胞瘤TERT启动子和ATRX突变预后价值[J]. 中国神经精神疾病杂志, 2023, 49(8): 449-455.
3. 何永跃, 陈礼刚. 胶质瘤免疫治疗与血脑屏障[J]. 国际神经病学神经外科学杂志, 2017, 44(1): 68-70.
4. BHUNIA S, KOLISHETTI N, VASHIST A, et al. Drug Delivery to the Brain: Recent Advances and Unmet Challenges[J]. Pharmaceutics, 2023, 15(12): 2658.
5. ALEXANDER A, AGRAWAL M, CHOUGULE M B, et al. Chapter 9 - Nose-to-brain drug delivery: an alternative approach for effective brain drug targeting[M]// SHEGOKAR R. Nanopharmaceuticals. Amsterdam: Elsevier, 2020: 175-200.
6. ALAVIAN F, SHAMS N. Oral and Intra-nasal Administration of Nanoparticles in the Cerebral Ischemia Treatment in Animal Experiments: Considering its Advantages and Disadvantages[J]. Curr Clin Pharmacol, 2020, 15(1): 20-29.
7. SABIR F, ISMAIL R, CSOKA I. Nose-to-brain delivery of antiglioblastoma drugs embedded into lipid nanocarrier systems: status quo and outlook[J]. Drug Discov Today, 2020, 25(1): 185-194.
8. WARNKEN Z N, SMYTH H D C, WATTS A B, et al. Formulation and device design to increase nose to brain drug delivery[J]. J Drug Deliv Sci Technol, 2016, 35: 213-222.
9. MARCELLO E, CHIONO V. Biomaterials-Enhanced Intranasal Delivery of Drugs as a Direct Route for Brain Targeting[J]. Int J Mol Sci, 2023, 24(4): 3390.
10. ZHA S, WONG K L, ALL A H. Intranasal Delivery of Functionalized Polymeric Nanomaterials to the Brain[J]. Adv Healthc Mater, 2022, 11(11): e2102610.
11. CHEN Y, ZHANG C, HUANG Y, et al. Intranasal drug delivery: The interaction between nanoparticles and the nose-to-brain pathway[J]. Adv Drug Deliv Rev, 2024, 207: 115196.
12. SELVARAJ K, GOWTHAMARAJAN K, KARRI V V S R. Nose to brain transport pathways an overview: potential of nanostructured lipid carriers in nose to brain targeting [J]. Artif Cells Nanomed Biotechnol, 2018, 46(8): 2088-2095.
13. SAHIN-YILMAZ A, NACLERIO R M. Anatomy and physiology of the upper airway [J]. Proc Am Thorac Soc, 2011, 8(1): 31-39.
14. ERDŐ F, BORS L A, FARKAS D, et al. Evaluation of intranasal delivery route of drug administration for brain targeting[J]. Brain Res Bull, 2018, 143: 155-170.
15. 王子慎, 彭明琪, 魏华, 等. 正常鼻骨细微解剖结构的MSCT影像学形态及法医学鉴定[J]. 法医学杂志, 2014, 30(3): 184-187.
16. GÄNGER S, SCHINDOWSKI K. Tailoring Formulations for Intranasal Nose-to-Brain Delivery: A Review on Architecture, Physico-Chemical Characteristics and Mucociliary Clearance of the Nasal Olfactory Mucosa[J]. Pharmaceutics, 2018, 10(3): 116.
17. HUANG Q, CHEN Y, ZHANG W, et al. Nanotechnology for enhanced nose-to-brain drug delivery in treating neurological diseases[J]. J Control Release, 2024, 366: 519-534.
18. BOURGANIS V, KAMMONA O, ALEXOPOULOS A, et al. Recent advances in carrier mediated nose-to-brain delivery of pharmaceutics[J]. Eur J Pharm Biopharm, 2018, 128: 337-362.
19. 王镛斐. 内镜鼻颅底外科在神经外科发展中的现状和展望[J]. 中国耳鼻咽喉颅底外科杂志, 2018, 24(4): 297-302.
20. CROWE T P, GREENLEE M H W, KANTHASAMY A G, et al. Mechanism of intranasal drug delivery directly to the brain[J]. Life Sci, 2018, 195: 44-52.
21. ILLUM L. Transport of drugs from the nasal cavity to the central nervous system[J]. Eur J Pharm Sci, 2000, 11(1): 1-18.
22. CHATTERJEE B, GORAIN B, MOHANANAIDU K, et al. Targeted drug delivery to the brain via intranasal nanoemulsion: Available proof of concept and existing challenges[J]. Int J Pharm, 2019, 565: 258-268.
23. KHAN A R, LIU M, KHAN M W, et al. Progress in brain targeting drug delivery system by nasal route[J]. J Control Release, 2017, 268: 364-389.
24. COSTA C, MOREIRA J N, AMARAL M H, et al. Nose-to-brain delivery of lipid-based nanosystems for epileptic seizures and anxiety crisis[J]. J Control Release, 2019, 295: 187-200.
25. MITCHELL M J, BILLINGSLEY M M, HALEY R M, et al. Engineering precision nanoparticles for drug delivery[J]. Nat Rev Drug Discov, 2021, 20(2): 101-124.
26. SIPOS B, CSÓKA I, BUDAI-SZŰCS M, et al. Development of dexamethasone-loaded mixed polymeric micelles for nasal delivery[J]. Eur J Pharm Sci, 2021, 166: 105960.
27. SHIM S, YOO H S. The Application of Mucoadhesive Chitosan Nanoparticles in Nasal Drug Delivery[J]. Mar Drugs, 2020,18(12): 605.
28. Van WOENSEL M, WAUTHOZ N, ROSIÈRE R, et al. Development of siRNA-loaded chitosan nanoparticles targeting Galectin-1 for the treatment of glioblastoma multiforme via intranasal administration[J]. J Control Release, 2016, 227: 71-81.
29. 谭奕珩, 罗美, 朱永红, 等. 免疫检查点抑制剂在垂体腺瘤中的研究进展[J]. 中国神经精神疾病杂志, 2021, 47(8): 497-501.
30. 牟永告. 脑胶质瘤免疫治疗研究进展[J]. 中山大学学报(医学科学版), 2020, 41(1): 24-29.
31. WEI J, WU D, ZHAO S, et al. Immunotherapy of Malignant Glioma by Noninvasive Administration of TLR9 Agonist CpG Nano‐Immunoadjuvant[J]. Adv Sci (Weinh), 2022,9(13): e2103689.
32. HAGHIRALSADAT F, AMOABEDINY G, NADERINEZHAD S, et al. Overview of Preparation Methods of Polymeric and Lipid-Based (Niosome, Solid Lipid, Liposome) Nanoparticles: A Comprehensive Review[J]. Int J Polym Mater, 2017,67(6):383-400.
33. AHMAD S, KHAN I, PANDIT J, et al. Brain targeted delivery of carmustine using chitosan coated nanoparticles via nasal route for glioblastoma treatment[J]. Int J Biol Macromol, 2022,221: 435-445.
34. SOUSA F, DHALIWAL H K, GATTACCECA F, et al. Enhanced anti-angiogenic effects of bevacizumab in glioblastoma treatment upon intranasal administration in polymeric nanoparticles[J]. J Control Release, 2019, 309: 37-47.
35. HU Y, JIANG K, WANG D, et al. Core-shell lipoplexes inducing active macropinocytosis promote intranasal delivery of c-Myc siRNA for treatment of glioblastoma[J]. Acta Biomater, 2022, 138: 478-490.
36. MICHELS L R, FACHEL F N S, SCHUH R S, et al. Nasal administration of a temozolomide-loaded thermoresponsive nanoemulsion reduces tumor growth in a preclinical glioblastoma model[J]. J Control Release, 2023, 355: 343-357.
37. 张振宇, 徐健, 钟平. 纳米载体在胶质瘤成像中的应用[J]. 中国神经精神疾病杂志, 2011, 37(9): 517-522.
38. SUKUMAR U K, BOSE R J C, MALHOTRA M, et al. Intranasal delivery of targeted polyfunctional gold–iron oxide nanoparticles loaded with therapeutic microRNAs for combined theranostic multimodality imaging and presensitization of glioblastoma to temozolomide[J]. Biomaterials, 2019, 218: 119342.
39. ZHANG Y, FANG Z, PAN D, et al. Dendritic Polymer-Based Nanomedicines Remodel the Tumor Stroma: Improve Drug Penetration and Enhance Anti-Tumor Immune Response[J]. Adv Mater, 2024, 12: e2401304.
40. HAN Y, JIANG M, SUN Y, et al. Efficient chemo-immunotherapy leveraging minimalist electrostatic complex nanoparticle as "in situ" vaccine integrated tumor ICD and immunoagonist[J]. J Adv Res, 2024, 16: S2090-1232(24)00108-5.
41. YIN P, LI H, KE C, et al. Intranasal Delivery of Immunotherapeutic Nanoformulations for Treatment of Glioma Through in situ Activation of Immune Response[J]. Int J Nanomedicine, 2020,15: 1499-1515.
42. HAN S, WANG J T, YAVUZ E, et al. Spatiotemporal tracking of gold nanorods after intranasal administration for brain targeting[J]. J Control Release, 2023, 357: 606-619.
43. KOU D, GAO Y, LI C, et al. Intranasal Pathway for Nanoparticles to Enter the Central Nervous System[J]. Nano Lett, 2023, 23(11): 5381-5390.
44. WANG Z, XIONG G, TSANG W C, et al. Nose-to-Brain Delivery[J]. J Pharmacol Exp Ther, 2019, 370(3): 593-601.
45. DERUYVER L, RIGAUT C, LAMBERT P, et al. The importance of pre-formulation studies and of 3D-printed nasal casts in the success of a pharmaceutical product intended for nose-to-brain delivery[J]. Adv Drug Deliv Rev, 2021, 175: 113826.
【引用格式】宋子彬,袁嘉杰,陈云娇,等.纳米材料在鼻脑通路治疗胶质母细胞瘤研究进展[J]. 中国神经精神疾病杂志,2024,50(3):183-188.
【Cite this article】SONG Z B,YUAN J J,CHEN Y J,et al.Research progress of nanomaterials in nose-to-brain delivery for glioblastoma treatment[J]. Chin J Nervous Mental Dis,2024,50(3):183-188
DOI:10.3969/j.issn.1002-0152.2024.03.013
作者:中国神经精神疾病杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#胶质母细胞瘤# #脂质体# #聚合物# #鼻脑通路# #无机金属纳米材料#
48