编者按:对于前期转移去势抵抗性前列腺癌(mCRPC)患者,雄激素受体(AR)靶向疗法,如阿比特龙和恩杂鲁胺会使大部分患者获益。接受AR靶向疗法治疗后,一部分患者会随着治疗产生对AR靶向疗法的抗性。肿瘤组织亚型类似新生小细胞癌,目前还不清楚治疗诱发的突变与新生小细胞癌是否是同种疾病实体,有学者称其为治疗诱发的小细胞神经内分泌分化性前列腺癌(t-SCNC)或神经内分泌前列腺癌(neuroendocrine prostate,cancer,NEPC)。现报道一例前列腺癌治疗相关NEPC。
本期「专家组稿」由河北医科大学第四医院崔彦芝教授担任执行主编,与新疆巴州人民医院戚锐锋教授、 吴冉医生共同分享《前列腺癌治疗相关NEPC个案报道》,为医者和患者提供更多参考。
基本情况:患者,男,74岁
主诉:进行性排尿困难15年,加重2月。
查体:直肠指诊:前列腺稍大,横径约6.0cm,表面光滑,质地较硬,轻压痛,双侧叶均可触及小结节,右侧叶明显,两侧叶饱满,中间沟变浅,前列腺远端触及不满意,精囊区正常。
既往史:既往有“慢性阻塞性肺病”病史4年。
泌尿系B超(2022-5-28):前列腺体积增大伴钙化;前列腺多发低回声结节(较大者大小约28×24mm;双肾、双侧输尿管、膀胱未见明显异常回声。
肿瘤标记物(2022-5-28):T-PSA 137.300 ng/ml,F-PSA 13.96 ng/ml,F/T 0.10 。
前列腺核磁平扫+增强(2022-5-31):1.前列腺移行带左侧部、外周带右侧部异常信号;2.精囊腺增大伴部分囊腔液平面,考虑:炎症合并出血;3.双侧髂血管多发肿大淋巴结显示;4.左侧耻骨、髂骨异常信号,考虑:转移。

穿刺活检:于2022-6-2行前列腺穿刺活检术,病理:前列腺腺泡腺癌(Cleason评分:3+3=6)。免疫组化:CK34βE12(-)、ERG(-)、P40(-)、P504s(+)、P63(-)、PSA(+)、AR(+)。
基因检测:CDK12 移码突变(exon1 c.330 del ,p.K110Nfs*14,49.86%;exon 2 c.1115del ,p.K372Rfs*64, 13.09%);BRAF 错义突变(exon 15 c.1801 A>G ,p.K601E, 32.69%);FGFR 错义突变(exon 18 c.2332 G>A ,p.E778K,46.33%);MSS;PD-L1免疫组化:TPS<1;CPS<1。
诊断:前列腺恶性肿瘤(腺泡腺癌 cT2N1M1 Ⅳ期) 骨转移
治疗经过:自2022年6月初开始口服阿比特龙+泼尼松片治疗,定期应用戈舍瑞林及地舒单抗治疗,T-PSA最低降至0.39ng/ml。
2023年1月因T-PSA升高至10.96ng/ml,更换为恩扎卢胺(国产),期间因恶心、腹胀、头晕等更换为进口药,副作用仍不能耐受,2023年4月更换为阿比特龙+泼尼松片,2023年6月T-PSA 2.23ng/ml。
因PSA缓慢升高,2023年7月T-PSA 4.47ng/ml,再次更换为恩扎卢胺。
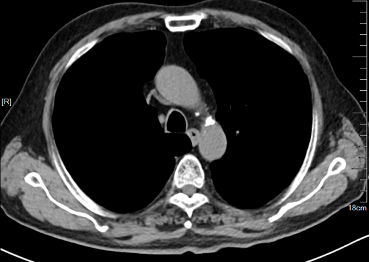
2023年8月TESTO <0.09nmol/L,T-PSA 4.05ng/ml ,NSE 45.35 ng/ml,ProGRP 272.30ng/ml,2023-8-10 CT:左肺上叶占位灶并纵膈多发淋巴结肿大,考虑:肿瘤,转移瘤不除外,与前片对比为新增;腹腔部分肠管周围间隙多发片絮状稍低密度影;颈6椎体、骶骨、双侧髂骨、双侧髋臼区、左侧耻骨联合异常密度,考虑:转移瘤。2023-8-9核磁:颈6椎体及颈7椎体附件、胸3、5、6、8、9、10、11椎体及胸12、腰1-骶1、3椎体或附件多发骨转移瘤。提示病情进展,调整为“多西他赛+泼尼松片”化疗2周期,耐受尚可。
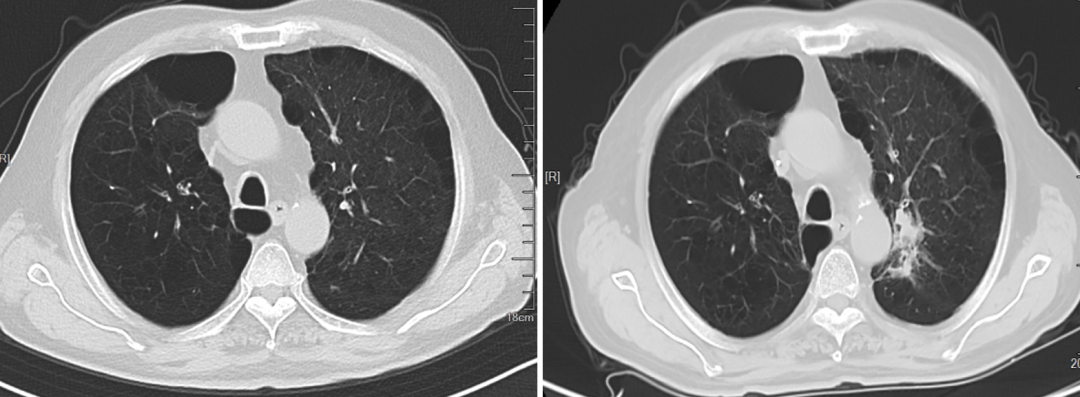
2023-1-2
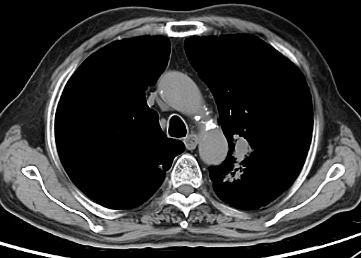
2023-8-10
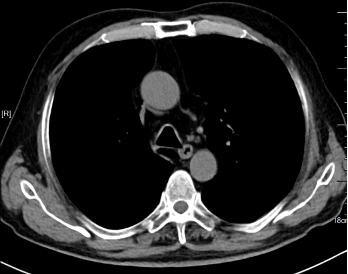
2023-1-2
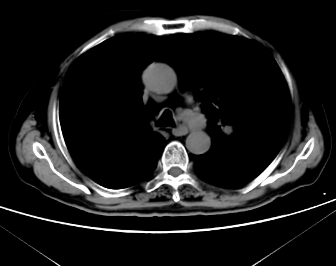
2023-8-10
2023年9月25日因T-PSA 8.70ng/ml,NSE 79.92ng/ml,CT提示纵隔淋巴结较前增大,脾脏结节灶与前片对比病灶增大。肝脏多发结节灶,考虑转移瘤,较前新增。核磁提示前列腺外周带左侧部部分病灶范围较前减小,双侧髂血管旁病灶此次显示不清。骨转移病灶明显增多、范围增大。调整为奥拉帕利片靶向治疗。
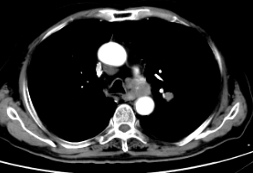
2023-8-10
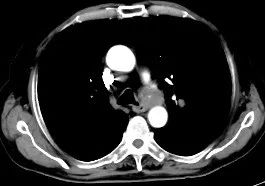
2023-9-26
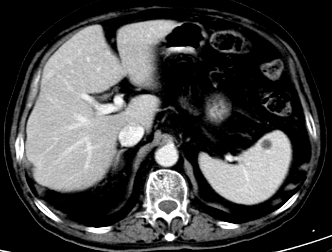
2023-8-10
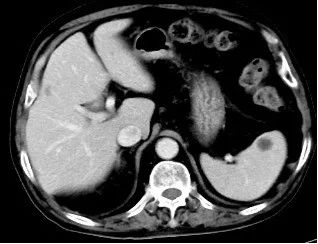
2023-9-26
自2023年10月20日患者出现腹痛,以“左下腹及脐周”为著,主要为绞痛,查肿瘤标记物T-PSA 12.00ng/ml ,NSE 35.51 ng/ml,ProGRP 313.40ng/ml。上消化道造影:提示胃炎,余未见明显异常。CT示:左肺上叶占位灶大小同前,纵隔淋巴结较前增大;升结肠憩室,腹腔部分肠管周围间隙多发片状稍低密度影,与前片对比部分吸收。胃肠镜未见明显异常。提示PD,停用奥拉帕利,解痉、止痛对症后腹痛无明显缓解,MDT会诊后再次行前列腺穿刺活检,病理:前列腺增生伴萎缩,其内见黏液,未见明确肿瘤。
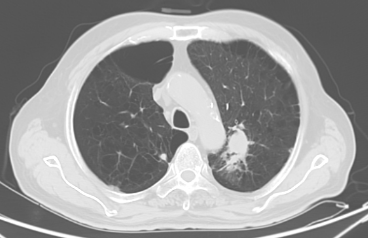
2023-9-26
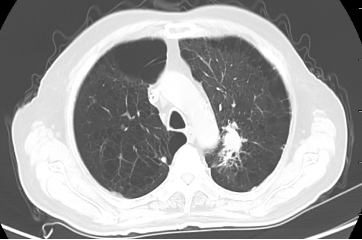
2023-10-30
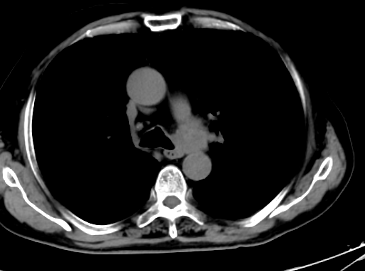
2023-9-26
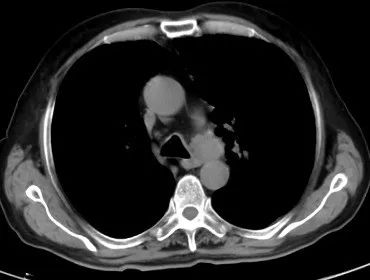
2023-10-30
2023年11月因腹痛、纳差、频繁恶心呕吐,就诊于中国医学院肿瘤医院,肿瘤标记物T-PSA 10.5ng/ml ,NSE 64.2ng/ml,ProGRP 678.72ng/ml。全消化道造影:提示消化道蠕动差,尤其胃及小肠。行PET-CT:腹部未见明显异常,肺内病灶较前明显增大。前列腺未见异常代谢征象,考虑治疗后无肿瘤活性。行肺转移灶穿刺后,病理:小细胞神经内分泌癌,结合病史及免疫组化染色结果符合前列腺来源。免疫组化:PSA(-),AR(-),TTF-1(+),NapsinA(-),P504s(+),CK7(+),CK20(-),CgA(部分+),Syn(弥漫+),CD56(弥漫+),ki67(+75%)。给予EP方案4个周期。因患者进食量少,化疗同时给予肠外营养支持治疗。2周期化疗后,恶心、腹痛较前好转,NSE、ProGRP正常,复查CT提示左肺上叶占位灶较前缩小,纵膈多发淋巴结较前缩小,肝脏部分低密度灶显示不清,脾脏结节灶,考虑:转移瘤,与前片对比病灶范围较前缩小。病情评估为PR。
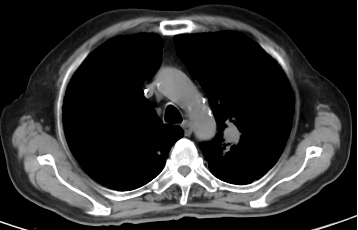
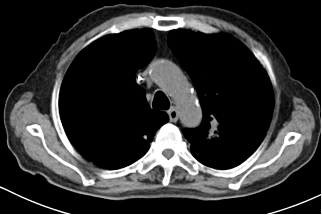
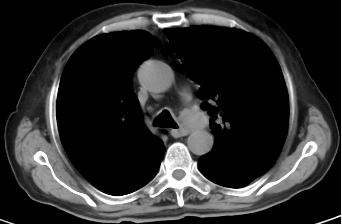
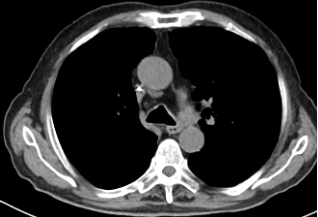
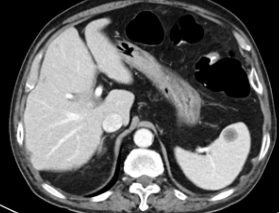
2023-10-27
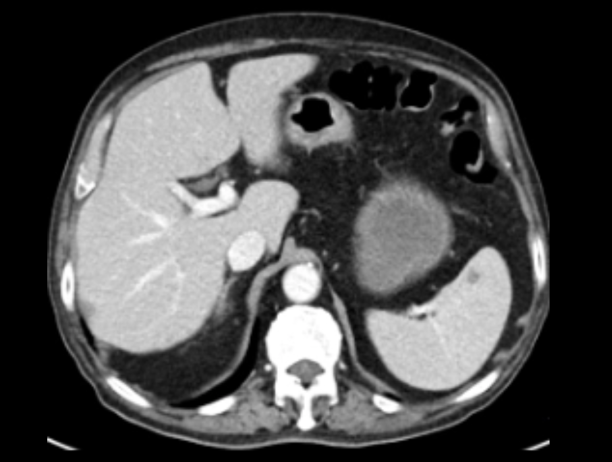
2023-12-30
2024年2月患者仍感恶心、腹痛、腹胀,每日进食量极少,2024年3月复查肿瘤标记物T-PSA 10.5ng/ml ,NSE 14.86ng/ml,ProGRP 268.30ng/ml。CT提示肺部病灶稳定,肝脏多发异常强化结节灶,考虑是转移瘤,前片对比为新发。评价:PD(肝),于2024-03-11开始给予阿替利珠单抗+伊立替康化疗2个周期,联合肝转移灶冷冻消融术。
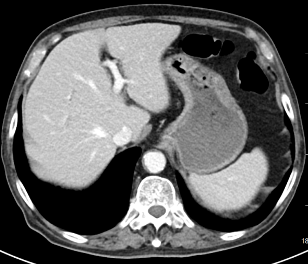
2023-12-30
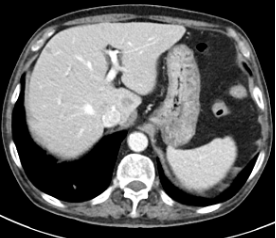
2024-3-8
治疗经过总结
一线治疗: ADT+新型内分泌治疗
2022年6月~2023年1月 ADT+醋酸阿比特龙+泼尼松
2023年1月~2023年4月 ADT+恩扎卢胺
2023年4月~2023年7月 ADT+醋酸阿比特龙+泼尼松
2023年7月~2023年8月 ADT+恩扎卢胺
二线治疗:2023年8月~2023年9月 ADT+多西他赛+泼尼松 ×2周期
三线治疗: 2023年9月~2023年10月 奥拉帕利(共1月)
四线治疗: 2023年11月~2024年2月 依托泊苷+卡铂×4周期
五线治疗: 2024年3月~2024年4月 阿替利珠单抗+伊立替康 ×2周期
+肝冷冻消融术
点评
1、雄激素剥夺治疗( androgen deprivation therapy, ADT) 为基础的联合治疗是转移性前列腺癌的标准治疗方案,然而其耐药性已成为新的挑战。
在初治前列腺癌患者中,局部进展和转移患者已占50%以上。雄激素剥夺治疗( androgen deprivation therapy, ADT)与新型内分泌药物(NHA)、化疗、放疗等其他治疗方法的合理结合已成为转移性前列腺癌的标准治疗方法。
转移性前列腺癌早期确诊或者未曾接受内分泌治疗往往对激素敏感,被称为转移性激素敏感性前列腺癌(Metastatic Hormone-Sensitive Prostate Cancer,mHSPC)。
LATITUDE和STAMPEDE研究先后证实ADT+醋酸阿比特龙联合泼尼松治疗可有效延长mHSPC的总生存时间。在LATITUDE研究中,醋酸阿比特龙组3年总生存率提高38%,死亡风险降低34%,中位总生存时间延长16.8个月[1]。在STAMPEDE研究中,醋酸阿比特龙组3年总生存率提高37%[2]。
ARCHES研究提示新型抗雄激素药物恩扎卢胺联合ADT治疗mHSPC可有效延长总生存时间,改善患者的rPFS(未达到vs.19.0个月)[3]。CHAARTED和STAMPEDE研究均提示多西他赛联合ADT可有效延长mHSPC的总生存时间。在CHAARTED研究中,多西他赛联合ADT组(未联用泼尼松)和单用ADT组的总生存时间分别是57.6个月和47.2个月(HR=0.72,P=0.0018)[4]。在STAMPEDE研究中,M1期患者联用多西他赛(联用泼尼松)有15个月的总生存获益[5]。
2、转移性去势抵抗性前列腺癌( metastatic castration - resistant prostate cancer,mCRPC)是前列腺癌的晚期阶段,尽管药物选择逐渐增多,治疗仍是难点。
mHSPC在经一段时间ADT、其他新型内分泌治疗或者化疗后,大都会进展到下一阶段,即mCRPC。mCRPC是前列腺癌进展的终末阶段。近年来 mCRPC 的治疗领域发生了巨大变化。醋酸阿比特龙、恩扎卢胺、多西他赛、卡巴他赛、Ra - 223等延长患者生存期的药物陆续用于临床,免疫检查点抑制剂、PARP抑制剂、Akt抑制剂、自体免疫细胞疗法等也在研究中初显疗效,有望为mCRPC患者个体化、精准化治疗带来希望。尽管药物选择逐渐增多,但 mCRPC的治疗仍是难点。用药时机、药物的选择和顺序、以及根据患者临床特征或基因特征选择最优的单一疗法或组合方案,仍需要进一步的研究和探索。
3、由于前列腺癌临床异质性的存在,基于二代测序的精准有效的分子分型可以更好的指导临床决策的制定。
推荐转移性前列腺癌患者进行基因检测,包括同源重组修复基因、错配修复基因、其他DNA修复相关基因、以及其他与前列腺癌治疗及预后相关基因。PROfound研究显示在mCRPC患者中,同源重组修复基因突变发生频率为27.9%[6]。该研究纳入的基因突变类型包括ATM,BRCA1,BRCA2,BARD1,BRIP1,CDK12,CHEK1,CHEK2,FANCL,PALB2,RAD51B,RAD51C,RAD51D,RAD54L[7]。导致DNA修复缺陷的相关基因的胚系变异和体细胞变异,均是铂类药物和PARP抑制剂的增敏性潜在生物标志物,如错配修复基因MSH2、MSH6、PMS2、MHL1、MRE11A,其他DNA修复基因如ATR、NBN、RAD51、FAM175A、EPCAM、HDAC2等[8]。
其他对于前列腺癌治疗选择及预后有指导意义基因,如AR-V7、TP53、RB1、PTEN等。对于既往接受一线醋酸阿比特龙或恩扎卢胺治疗并进展的mCRPC患者在准备进行二线治疗前行AR-V7的检测,AR-V7阳性mCRPC患者可能从紫杉类化疗中获益[9]。TP53基因突变是前列腺癌中的常见突变,在中国激素敏感前列腺癌中突变比例是22.3%[10],TP53突变提示患者对阿比特龙或恩扎卢胺治疗不敏感[11-12]。
4、CDK12基因突变前列腺癌临床预后差,易发生去势抵抗,是否可从PARP 抑制剂中获益不明确,可用于免疫治疗。
CDK12基因突变在mCRPC患者中的突变频率显著高于原发性局限性前列腺癌患者。CDK12基因突变前列腺癌患者恶性程度高,易发生去势抵抗,新型内分泌治疗和紫杉烷类化疗的疗效较差。CDK12与同源重组修复基因的转录调控有关,已成为潜在的 PARP 抑制剂合成致死效应的靶向候选生物标志物。然而,初步的临床证据表明,对于携带 CDK12突变的晚期前列腺癌患者而言,PARP抑制剂治疗可能在很大程度上是无效的,其是否可从铂类化疗、PARP 抑制剂中产生获益目前仍不明确。CDK12突变的前列腺癌的具有新抗原融合比例高、免疫浸润及 PD-1 / PD-L1 抑制剂应答率高等特点,免疫检查点抑制剂治疗对部分CDK12突变的 mCRPC患者有效,CDK12 可能是目前免疫检查点抑制剂治疗的潜在基因组生物标志物。因此对于存在该类突变的前列腺癌患者,未来尚需要进一步研究探索以期发现新的治疗靶点。
5、神经内分泌前列腺癌(neuroendocrine prostate,cancer,NEPC)是前列腺癌的一种侵袭性变异,是晚期前列腺癌耐药的重要原因。
NEPC是前列腺癌的一种具有高度侵袭性的组织学亚型,初诊时NEPC极少见,约占2%。在11%~17%接受过激素治疗的前列腺腺癌患者中可观察到NEPC,考虑前列腺癌抗雄激素治疗诱导的治疗相关NEPC(treatment-emergent neuroendocrine prostate cancer,t-NEPC)。目前大量临床与实验研究已经证实,去势治疗在NEPC发生过程中发挥了重要作用。NEPC特征性表现是雄激素受体和PSA、PSMA等前列腺特异性标志物表达下降,而CHGA、CEA和NSE等神经相关标志物表达升高。在NEPC中AR转录活性降低,存在抑癌基因TP53、RB1和PTEN的双等位基因缺失和/或突变。需要注意的是DNA修复通路基因中有害突变和/或拷贝数丢失与t-NEPC几乎完全相互排斥。
NEPC预后极差,其和小细胞肺癌在临床、病理和分子生物学方面较为相似,因此被证实为 NEPC 或者具有侵袭性变异特征的 CRPC,患者通常采用小细胞肺癌的治疗方案。NEPC目前的治疗仍是以铂类为基础的化疗。研究显示一线铂类药物治疗的客观有效率(ORR)为66.7%,中位PFS为7.5个月,中位OS为20.3个月[14]。但二线及以后的治疗措施是目前面临的主要临床挑战。
在当前病例中,患者为CDK12基因突变晚期前列腺癌,很快发生去势抵抗,发展为CRPC,且新型内分泌治疗和紫杉烷类化疗的疗效较差,PARP抑制剂治疗无效,符合CDK12基因突变前列腺癌的临床及预后特征。此外,该患者PSA不高但肿瘤进展迅速、大量骨转移病灶且影像学检查提示溶解性骨转移为主、开始激素治疗后到雄激素非依赖性进展的时间短,亦提示患者为发生神经内分泌癌的高危人群。在患者出现CHGA、NSE等血清标志物升高的情况下,重新活检为t-NEPC,给予EP方案化疗后,获得了3个月PFS。对于患者肿瘤进展中出现腹痛、纳差、恶心、呕吐,影响进食等症状,影像学无明显阳性发现,不除外与类癌综合征有关。当肿瘤再次进展后,给予2周期阿替利珠单抗+伊立替康,联合肝转移灶局部治疗,目前病情控制稳定,提示CDK12基因突变前列腺癌可能从免疫治疗中获益。
对于前列腺癌的管理,需要基于循证医学的证据,及时根据国内外指南,不断更新诊疗理念,从而进一步优化患者的生存和预后。
参考文献:
[1] FIZAZI K,NAMPHUONG TRAN,LUIS FEIN,et al.Abiraterone acetate plusprednisone in patients with newly diagnosed high-risk metastatic castration-sensitive prostate cancer (LATITUDE):final overall survival analysis of a randomised,double-Blind,phase 3 trial.Lancet Oncol,2019,20(5):686-700.
[2] JAMES N D,DE BONO J S,SPEARS M R,et al.Abiraterone for prostate cancer not previously treated with hormone therapy.N Engl J Med,2017,377 (4):338-351.
[3] ARMSTRONG A J,SZMULEWITZ R Z,PETRYLAK D P,et al.ARCHES:Arandomized,phase Ⅲ study of androgen deprivation therapy with enzalutamide or placebo in men with metastatic hormone- sensitive prostate cancer.J Clin Oncol,2019,37(32):2974-2986.
[4] SOLOWAY M S,SCHELLHAMMER P,SHARIFI R,et al.A controlled trial of Casodex (bicalu-tamide) vs. flutamide,each in combination with luteinising hormone-releasing hormone analogue therapy in patients with advanced prostate cancer.Casodex Combination Study Group.Eur Urol,1996,29 (Suppl2):105-109.
[5] SWEENEY C J,CHEN Y H,CARDUCCI M,et al. Chemohormonal therapy in metastatic hormone-sensitive prostate cancer.N Engl J Med,2015,373 (8):737-746.
[6] European Society for Medical Oncology (ESMO)and European Association for Cancer Research (EACR),2019 EUROPEAN SOCIETY FOR MEDICALONCOLOGY Breast Cancer annual meeting (ESMO 2019),Berlin,Germany,2019.
[7] DE BONO J,MATEO J, FIZAZI K,et al. Olaparib for metastatic castration-resistant prostate cancer. N Engl J Med,2020,382 (22):2091-2102.
[8] MATEO J,CARREIRA S, SANDHU S, et al.DNA-repair defects and olaparib in metastatic prostate cancer.N Engl J Med,2015,373 (18):1697-1708.
[9] SCHER HI,GRAF RP,SCHREIBER NA,et al.Assessment of the validity of nuclear-localized androgen receptor splice variant 7 in circulating tumor cells as a predictive biomarker for castration- resistant prostate cancer.JAMA Oncol,2018,4 (9):1179-1186.
[10] LIU Z,GUO H,ZHU Y, et al.TP53 alterations of hormone-naive prostatecancer in the Chinese population.Prostate Cancer Prostatic Dis,2021,24(2): 482-491.
[11] ANNALA M,VANDEKERKHOVE G,KHALAF D,et al.Circulating tumor DNA genomics correlate with resistance to abiraterone and enzalutamide inprostate cancer.Cancer Dis- cov,2018,8(4):444-457.
[12] DE LAERE B,OEYEN S,MAYRHOFER M,et al. TP53 outperforms other androgen receptor bio-markers to predict abiraterone or enzalutamide outcome in metastatic castration-resistant prostate cancer.Clin CancerRe s,2019,25 (6):1766-1773.
作者:医悦汇
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#前列腺癌# #NEPC#
5