JAMA Oncology:NRAS和BRAF突变与高危型原发黑色素瘤生存期的关系
2015-04-14 Zhang JL译 MedSci原创
NRAS与BRAF突变在多年以前已经发现存在于黑色素瘤中。然而,这两个基因突变对患者生存率的影响却尚未阐明。为了研究高危型黑色素瘤的死亡与这两个基因突变的关系,为黑色素瘤患者随访以及后续辅助治疗的需要评估,研究人员对此进行了研究。该项研究结果发表在最新一期JAMA Oncology杂志上。该项研究目的,在于阐明NRAS和BRAF突变与原发黑色素瘤的生存率以及肿瘤特征之间的关系。研究人员进行了一项以
NRAS与BRAF突变在多年以前已经发现存在于黑色素瘤中。然而,这两个基因突变对患者生存率的影响却尚未阐明。为了研究高危型黑色素瘤的死亡与这两个基因突变的关系,为黑色素瘤患者随访以及后续辅助治疗的需要评估,研究人员对此进行了研究。该项研究结果发表在最新一期JAMA Oncology杂志上。
该项研究目的,在于阐明NRAS和BRAF突变与原发黑色素瘤的生存率以及肿瘤特征之间的关系。
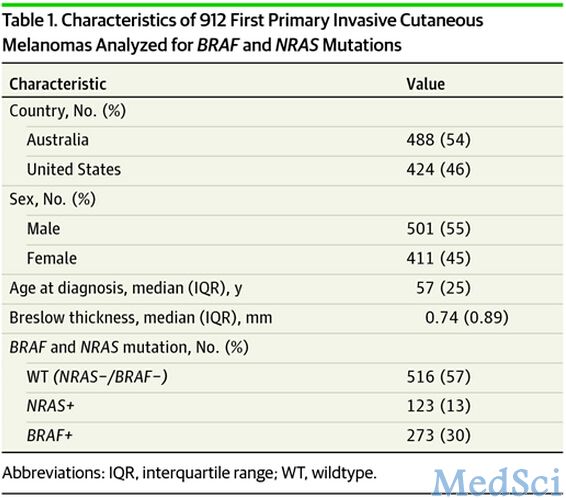
研究人员进行了一项以人群为基础的研究,平均随访时间为7.6年,包括912个来自美国和澳大利亚的基因、环境和黑色素瘤(GEM)研究中的病例。这些病例均在2000年诊断为黑色素瘤并对其进行了NRAS和BRAF突变分析。
在澳大利亚和美国,原发黑色素瘤中NRAS阳性占13%,BRAF占30%,两者均阴性(WT)占57%。在包括临床病理特点的多变量分析中,相比WT黑色素瘤,NRAS阳性黑素瘤与有丝分裂的存在相关(优势比为1.8,95%置信区间[1.0-3.3]),与较低的白细胞浸润(TIL)等级相关(非急性0.5(0.3-0.8),急性0.3[0.5-0.7][与无TILs相比]),与非头颈部发病部位相关(0.1[0.01-0.6]头皮/颈部VS躯干/骨盆)。而BRAF阳性黑素瘤与更为年轻的患病年龄相关(年龄在50-69为0.7(0.5-1.0),年龄> 70为0.5[0.3 - -0.8][对比年龄< 50岁),与表面扩散亚型相关(结节状为0.5(0.2-1.0);斑点状为0.4(0.2-0.7),和未分类/其他为0.2[0.1-0.5][与表面扩散相比]),和有丝分裂的存在相关(1.7[1.1—-2.6])(所有对比差异P<0.05)。
原始出处:
Thomas NE, Edmiston SN, Alexander A, et al. Association Between NRAS and BRAF Mutational Status and Melanoma-Specific Survival Among Patients With Higher-Risk Primary Melanoma.JAMA Oncol. Published online April 09, 2015. doi:10.1001/jamaoncol.2015.0493.
作者:Zhang JL译
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#色素#
38
#NRAS#
49
#Oncology#
39
#Oncol#
32
#BRAF#
27