帕金森病:睡眠障碍与昼夜节律
2024-05-07 神经科学论坛 神经科学论坛
帕金森病是一种进行性神经退行性疾病,具有运动和非运动症状,包括睡眠功能障碍。非运动症状对生活质量有负面影响,并且通常比运动症状更令人烦恼。
论坛导读:帕金森病(PD)是一种以运动和非运动特征为特征的神经退行性疾病。睡眠中断,包括快速眼动睡眠行为障碍和昼夜节律功能障碍,是公认的帕金森病的前驱症状,尽管其他特征如不宁腿综合征和其他身体因素也可能起作用。由于帕金森病的多因素性质,帕金森病的治疗仍然具有挑战性,需要一个整体的方法。加深对主要病因的理解可能是开发新的、有效的和有针对性的治疗方法的关键。
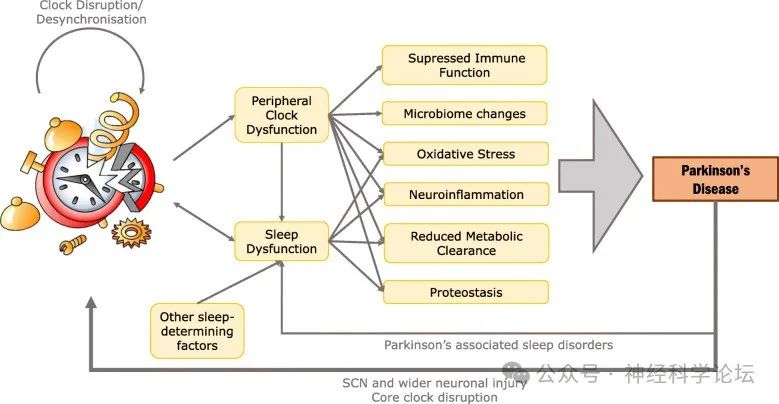
帕金森病是一种进行性神经退行性疾病,具有运动和非运动症状,包括睡眠功能障碍。非运动症状对生活质量有负面影响,并且通常比运动症状更令人烦恼。睡眠障碍影响74-98%的帕金森病患者,包括睡眠分裂、快速眼动睡眠行为障碍、白天嗜睡和失眠。帕金森病患者的睡眠结构也有改变,睡眠效率(实际睡眠时间在床上的百分比)、总睡眠时间和慢波睡眠减少。除了对生活质量产生负面影响外,帕金森病的睡眠障碍还与抑郁、精神病、自主神经功能障碍、更严重的运动残疾、疲劳和神经炎症有关。
帕金森的分类强调患者经常“持续困倦”和“筋疲力尽”;最近的一项系统性文献综述发现高达80 %的帕金森病患者患有睡眠-觉醒障碍。一系列研究小组使用各种昼夜节律测量方法研究了帕金森病患者的昼夜节律变化。夜间高血压在帕金森病中几乎无处不在,患者通常表现出血压昼夜节律逆转,夜间血压高于或等于白天水平。PD患者还被观察到昼夜体温调节紊乱,核心体温(CBT)节律和CBT节律减弱的mesor(波函数围绕其振荡的反应变量的节律调整平均水平)显著降低,这两者都与严重的睡眠问题密切相关。内分泌参数被认为是主要的昼夜节律指标,激素节律的中断在帕金森病中已得到强调。特别是,PD患者的血浆褪黑素浓度没有表现出显著的日间依赖性变化。此外,在PD患者中,每日皮质醇分泌曲线,特别是其峰值被压缩。值得注意的是,其他一些昼夜节律调节激素在帕金森病中似乎不受影响,包括生长激素、促甲状腺激素、催乳素以及某些脂肪组织相关激素
睡眠障碍可出现在PD前驱期,并随着疾病的进展而进展。除了是神经退化的症状外,睡眠障碍也可能导致疾病进展。目前,调节帕金森病患者睡眠障碍的选择有限。在皮质和皮质下水平研究影响帕金森病患者睡眠的神经生理变化可能会对逆转睡眠中断的机制产生新的见解。研究表明慢波睡眠和快速眼动睡眠在帕金森病中都受到明显干扰。在帕金森病患者中睡眠宏观结构(例如表现为睡眠碎片化和浅睡眠相对增加)和睡眠微观结构(表现为某些睡眠阶段的完整性受到干扰(例如睡眠纺锤波和K-复合波受到干扰,或快速眼动睡眠期间肌肉松弛不足)都受到影响。
睡眠和觉醒调节依赖于多个脑区和神经递质的高度复杂和整合的功能,其中许多功能也已被证明会影响帕金森病患者。在这种病理生理学背景下,睡眠和觉醒障碍在帕金森病患者中几乎无处不在就不足为奇了。1988年进行的一项经常被引用的调查发现,在帕金森病患者中,98%的人自疾病发作以来在夜间或醒着时经历过残疾,失眠调节被证明是高达30%的帕金森病患者的一个突出特征。除了与帕金森病相关的大脑和神经递质功能损害外,还有其他主要因素导致帕金森病患者睡眠和觉醒障碍,包括多巴胺能药物(已知会影响睡眠和觉醒的调节)以及在老年人和多病人群中使用的其他药物、共病、损害患者睡眠的帕金森病症状(如夜间运动不能)和易导致某些睡眠和觉醒障碍的遗传因素。此外,生活方式因素和冲动控制障碍(多巴胺能药物的常见副作用)也可能在帕金森病患者睡眠障碍的发展和持续中发挥作用。
帕金森病的一个有趣但经常被忽视的特征涉及睡眠和运动功能的相互作用,睡眠有益,即一些患者在醒来后运动功能改善,而另一些患者则经历了睡眠剥夺对运动功能的积极影响。在过去的三十年里,多项研究试图评估帕金森病患者RLS的发生率,结果差异很大,从0%到52.3%不等。除了这些差异,一些作者早期指出,由于RLS症状与清晨肌张力障碍、静坐不能、疼痛性神经病、夜间运动功能减退(可能与报告的运动冲动有关)、双相运动障碍和夜间腿部痉挛的潜在重叠,PD患者的RLS诊断可能是混杂的。有趣的是,RLS增加很少出现在PD患者中,可能是因为RLS(多巴胺功能障碍)和PD(多巴胺缺乏)中多巴胺能回路的不同潜在改变,以及这些改变的回路对多巴胺/多巴胺能治疗的不同反应。
帕金森病的睡眠障碍范围包括国际睡眠障碍分类第三版(ICSD-3)中概述的所有睡眠障碍类别。因此,帕金森病患者明显的睡眠障碍类型包括失眠、日间嗜睡障碍、睡眠相关呼吸障碍、昼夜节律障碍和睡眠相关运动障碍,即不宁腿综合征(RLS)和睡眠障碍。这种睡眠表型的异质性可能反映了众所周知的帕金森病运动表型的异质性以及帕金森病的生物(生物标志物)异质性。RBD影响了高达47%的帕金森病患者。在过去,由于RBD可能比帕金森病早10多年,因此受到了广泛关注,但也有可能RBD病与帕金森病或多或少同时发作,或者RBD病比帕金森病晚几年发作。RBD的诊断标准包括睡眠相关发声和/或复杂运动行为的反复发作,这些行为需要由PSG记录为发生在快速眼动睡眠期间,或者根据做梦的临床病史,被推定为发生在快速眼动睡眠期间。此外,多导睡眠图记录必须证明快速眼动睡眠没有弛缓。帕金森病中常见的其他睡眠相关运动障碍(如PLMS、睡眠呼吸暂停)可能会产生与既往RBD病相似的症状,需要排除。在帕金森病患者中除了RBD的发生外,还描述了非快速眼动睡眠睡眠障碍(如梦游)和睡眠障碍重叠障碍。
国际帕金森和运动障碍学会已经计算出,在孤立性(以前称为“特发性”)RBD患者中,PSG确认的患前驱PD的概率超过80%的可能性比为130。然而,这是真的,并且仅在vPSG证实的RBD中被广泛证实。事实上,如果对RBD筛查试验呈阳性反应,且记录的特异性为80-99 %,可能性比率下降到2.3。考虑到越来越多的研究报告了在验证研究范围之外的RBD验证问卷的较低特异性,这一点甚至更加重要。
从孤立的RBD到α突触核蛋白病(即PD、路易体痴呆或罕见的MSA)的转化率非常高,这使得一些作者在此提出,RBD本身需要被认为不仅仅是REM-睡眠障碍,因为它代表了α突触核蛋白病或α突触核蛋白病的早期表现。对于临床研究,将分离的RBD与其他帕金森/α-突触核蛋白相关的神经退行性变风险标志物联合可能是最有用的方法。已经描述了多种α突触核蛋白相关神经变性的生物标志物,并且可以用于评估神经变性的不同方面,并且虽然一些如嗅觉功能障碍是指示短期转化风险较高的稳定标志物,但其他如DAT-SPECT是用于监测疾病随时间进展的渐进标志物。
脑组织中的α-突触核蛋白聚集是帕金森病的核心病理标志。脑脊液(CSF)中这种蛋白的常规检测目前尚未被确定为诊断或监测疾病进展的有用或必要的生物标志物。然而,最近的研究表明,与健康对照组相比,帕金森病患者的脑脊液α-突触核蛋白水平较低。脑脊液中α-突触核蛋白的水平似乎与快速眼动睡眠行为障碍有关,这可能表明是时候进行治疗干预了。导致α-突触核蛋白聚集的淋巴功能障碍是一个令人感兴趣的新兴领域,但成像的作用需要更多的验证。
睡眠障碍在帕金森病很常见,包括所有的睡眠障碍。一方面,在帕金森病,睡眠和清醒的调节受到影响,导致疾病的发展,如失眠和白天嗜睡。而另一方面,睡眠期间对运动活动的控制受损,随后表现出睡眠障碍(主要是快速眼动睡眠行为障碍,但也有梦游和重叠睡眠障碍,尽管这种情况较少见)。据报道,不宁腿综合征在帕金森病患者中很常见,尽管对于它在帕金森病是否比在普通人群中更常见尚无共识。与睡眠相关的呼吸障碍也是如此。关于帕金森病患者睡眠障碍的诊断,主要挑战之一是正确识别白天过度嗜睡,因为有许多潜在的混淆因素,例如有必要将睡眠相关的呼吸障碍与药物作用区分开来,并将不宁腿综合征与伴随出现的帕金森病特有的潜在模拟症状区分开来,如静坐不能、夜间腿部痉挛、夜间运动功能减退、清晨肌张力障碍等。快速眼动睡眠行为障碍的正确诊断也不总是容易的,应进行视频多导睡眠描记术,以排除睡眠呼吸暂停结束时的模仿性运动或睡眠中剧烈的周期性腿部运动。
尽管睡眠功能障碍对帕金森病有显著的负面影响,但很少有药物疗法能有效改善这些症状,而且可用的治疗方法可能具有有害的副作用。因此,运动等非药物疗法是治疗帕金森病睡眠功能障碍的有前途的替代方法。研究表明,运动对帕金森病的影响对运动症状和生活质量具有有益的影响,并且是安全可行的。抗阻训练和体重间歇训练相结合的高强度运动康复可以改善帕金森病患者的运动症状、生活质量、神经肌肉表现、运动单位完整性和肌肉线粒体功能。此外,功能磁共振成像显示,这种干预导致黑质和前额叶皮层的静息状态活动增强。
基于目前动物模型研究的发现必须根据进一步的帕金森研究重新评估当前帕金森模型的目的。这里要指出的一个关键点是,在化学损伤诱导神经变性和帕金森症状的神经毒性模型中,研究仅限于症状管理和潜在的神经发生,不适合探索导致人类帕金森病发展的潜在机制。在睡眠和昼夜节律功能障碍的特定背景下,只能看到某些大脑区域的退化对睡眠和昼夜节律的影响。另一方面,在PFF和转基因模型中,可以更准确地再现疾病的进展性质,可以研究睡眠和退化之间的界面和相互作用,以及潜在治疗方法对疾病进展的影响。当考虑到睡眠中断经常出现在运动症状出现之前时,这种差异尤其明显,这是一种无法在神经毒性模型中研究的现象。出于这个原因,特别是在帕金森病的睡眠和昼夜节律方面的背景下,作者认为疾病的转基因模型对于理解这些机制将变得更加重要。这是这些模型必须更全面分类的部分原因,以帮助解开疾病进展和睡眠缺陷之间的双向相互作用。
参考文献
Hawken J, Robertson N. Sleep disorders in Parkinson's disease. J Neurol. 2022 Dec;269(12):6685-6687. doi: 10.1007/s00415-022-11403-5.
Zahed H, Zuzuarregui JRP, Gilron R, Denison T, Starr PA, Little S. The Neurophysiology of Sleep in Parkinson's Disease. Mov Disord. 2021 Jul;36(7):1526-1542. doi: 10.1002/mds.28562.
Amara AW, Wood KH, Joop A, Memon RA, Pilkington J, Tuggle SC, Reams J, Barrett MJ, Edwards DA, Weltman AL, Hurt CP, Cutter G, Bamman MM. Randomized, Controlled Trial of Exercise on Objective and Subjective Sleep in Parkinson's Disease. Mov Disord. 2020 Jun;35(6):947-958. doi: 10.1002/mds.28009.
Stefani A, Högl B. Sleep in Parkinson's disease. Neuropsychopharmacology. 2020 Jan;45(1):121-128. doi: 10.1038/s41386-019-0448-y.
Hunt J, Coulson EJ, Rajnarayanan R, Oster H, Videnovic A, Rawashdeh O. Sleep and circadian rhythms in Parkinson's disease and preclinical models. Mol Neurodegener. 2022 Jan 9;17(1):2. doi: 10.1186/s13024-021-00504-w.
作者:神经科学论坛
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#帕金森病# #昼夜节律# #睡眠障碍#
9