【Blood】尼洛替尼+化疗±阿糖胞苷治疗Ph+ ALL的随机研究结果
2024-03-25 聊聊血液 聊聊血液
研究目的是在不影响BCR::ABL1可测量残留病(MRD,无复发生存期[RFS]的潜在替代标志物)反应深度的情况下降低毒性。
Ph+ ALL
在TKI前时代,费城染色体阳性急性淋巴细胞白血病(Ph+ ALL)的预后极差,TKI出现后彻底改变了现状。随机GRAAPH-2005研究证明,低强度诱导化疗联合伊马替尼可安全替代标准方案Hyper-CVAD联合伊马替尼,具有较低的早期死亡率和较高的CR率,且患者仍可获益于allo-SCT。此外,二代TKI达沙替尼(序贯allo-SCT)和三代TKI ponatinib(不序贯allo-SCT)联合Hyper-CVAD也具有较好的疗效,
仍存在的问题包括,如何联合TKI和化疗以实现进一步的化疗降级,以及是否CR1进行allo-SCT。因此学者启动了一项随机研究,在第1个周期和第3个周期使用减低强度方案联合持续尼洛替尼,并在第2个周期和第4个周期进行随机(尼洛替尼+甲氨蝶呤联合/不联合大剂量阿糖胞苷)以探索大剂量阿糖胞苷(HD-AraC)的作用,两组均连续给予尼洛替尼直至SCT;随后在SCT后接受为期2年的系统性伊马替尼维持治疗。研究目的是在不影响BCR::ABL1可测量残留病(MRD,无复发生存期[RFS]的潜在替代标志物)反应深度的情况下降低毒性。研究计划入组265例,在入组156例的时候因研究组复发率过高而终止,156例的结果近日发表于《Blood》。
本文要点
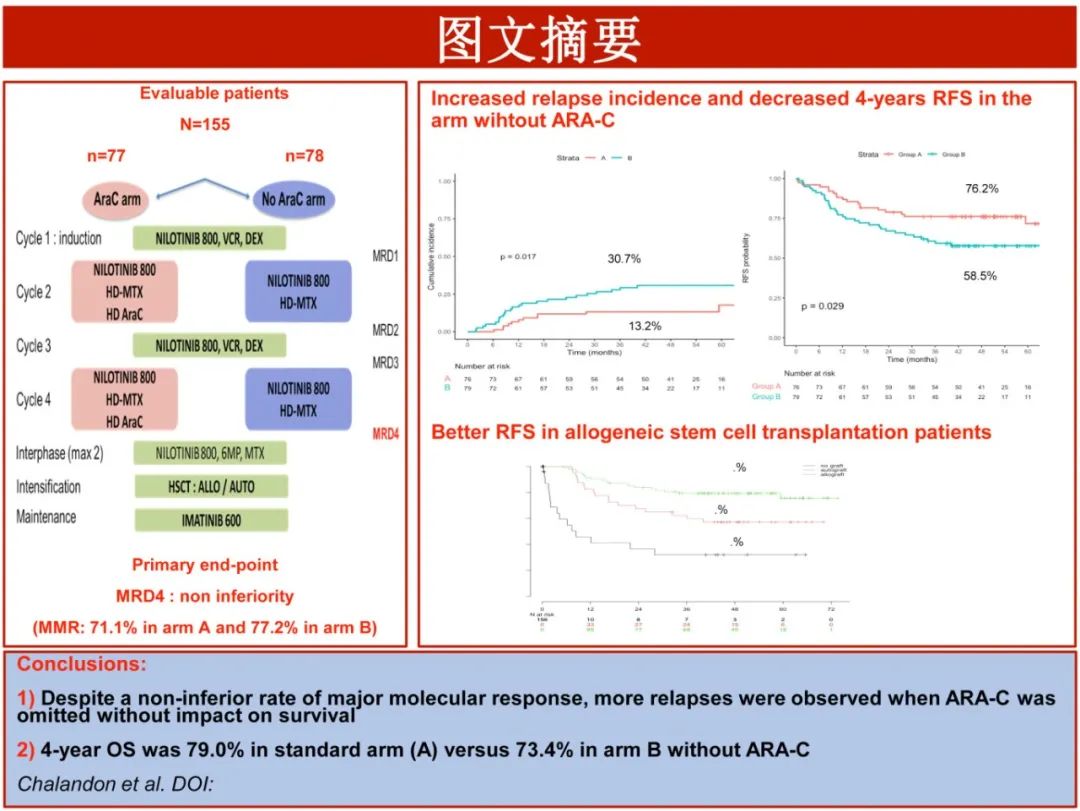
1、减低强度化疗交替常规化疗联合尼洛替尼序贯SCT治疗Ph+ ALL患者的4年OS为79.4%。
2、巩固治疗期间未使用大剂量Ara-C导致显著较高的复发率,但不影响总生存期
研究方法
该前瞻性、开放标签、非劣效、多中心、随机GRAAPH-2014研究在法国、比利时和瑞士79家中心开展,纳入18-59岁、Ph+和/或BCR::ABL1+前体 B 细胞 (BCP) ALL,Ph+是通过核型分析和/或BCR::ABL1+(FISH)和/或BCR::ABL1转录物(定性逆转录PCR)。患者均接受尼洛替尼,并1:1随机接受甲氨蝶呤和HD-Ara-C(A组)或仅甲氨蝶呤(B组)。具体治疗见表1。患者在类固醇前期治疗后随机分组,并在TP4 MRD(通过定性逆转录PCR定量BCR::ABL1融合转录物)评估前分配接受4个周期的诱导/巩固治疗:所有患者在第1和第3周期第1-28天接受尼洛替尼400mg bid,第1-2、8-9、15-16和22-23天接受 40mg 地塞米松,第1、8、15和22天接受 2mg 长春新碱。A 组患者在第2和4周期第1-28天接受尼洛替尼 400mg bid,第1天连续 IV 给予甲氨蝶呤1 g/m2,第2天和第3天给予HD-Ara-C 3g/m2(≥45岁患者降至1.5 g/m2)bid;B 组患者接受与周期2和4相同方案但不联合Ara-C。各周期之间未中断尼洛替尼治疗。

TP4时MRR患者可接受allo-SCT(来自遗传或非亲缘9/10或10/10 HLA相容供者)或自体SCT(auto-SCT),根据研究者判断。
MMR 定义为骨髓中BCR::ABL1/ABL1比值≤0.1%,CMR即未检出MRD(灵敏度至少为0.01%)。主要终点为在巩固治疗结束时(第4周期后,即TP4)的主要分子学反应(MMR)。
研究结果
患者
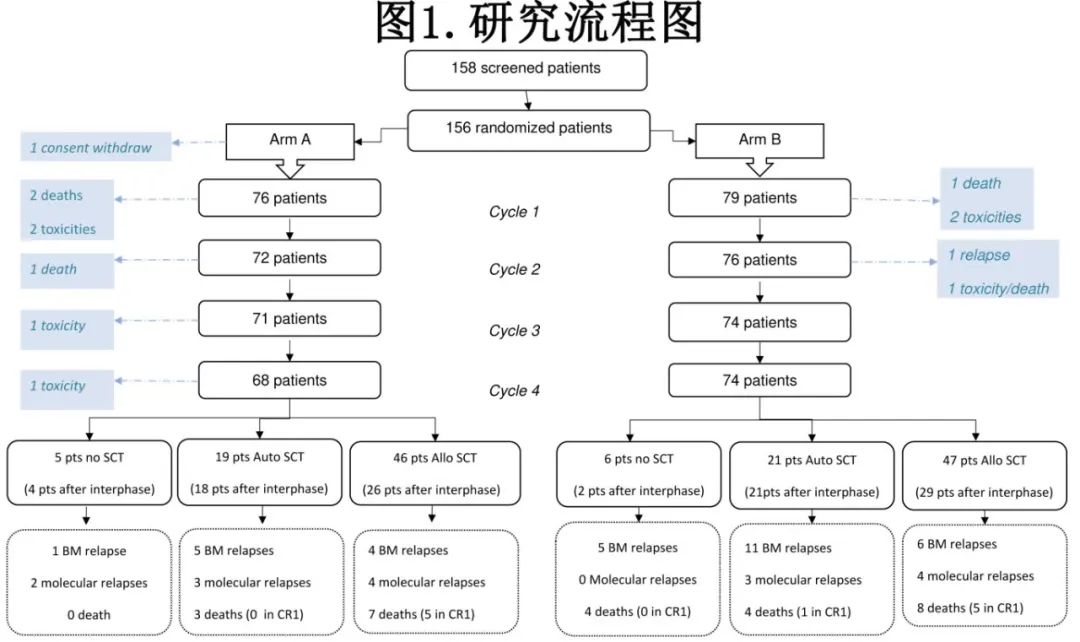
入组的156例患者中,中位随访时间为3.8年,包括HD-MTX+HD-Ara-C方案(A组)79例和不含HD-Ara-C (B组)79例。A组1例患者撤回知情,因此155例纳入全分析集(图1)。
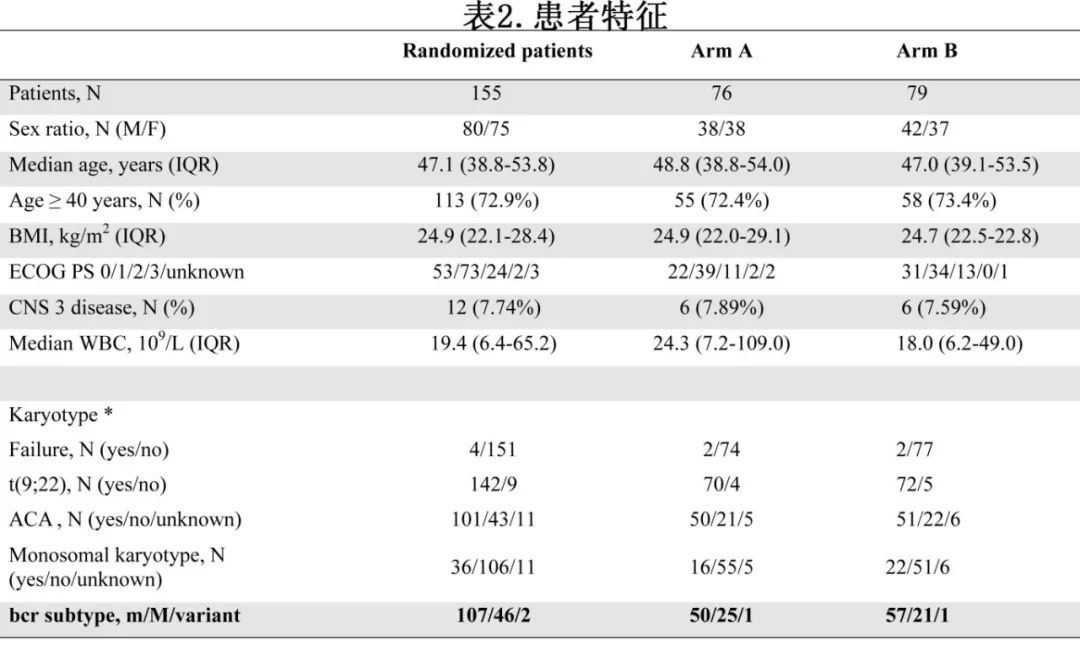
除B组男性较多外,两组的患者特征很平衡 (表2)。中位年龄为47.1岁。所有患者进行核型分析但4例失败,核型分析142例患者存在t(9;22)(q34;q11)/费城(Ph)染色体;95例患者行BCR::ABL1 FISH检测,95例阳性,包括9例Ph染色体缺失。155例患者可进行BCR::ABL1检测,有107例m-bcr和45例M-bcr融合和2例变异体(表2)。101例患者观察到额外的细胞遗传学异常(ACA), m-bc病例比M-bcr病例中更常见(75.5% vs 56.8%,p=0.031)。M-bcr和ACA患者的年龄、白细胞计数(WBC)差异无统计学意义。
主要终点
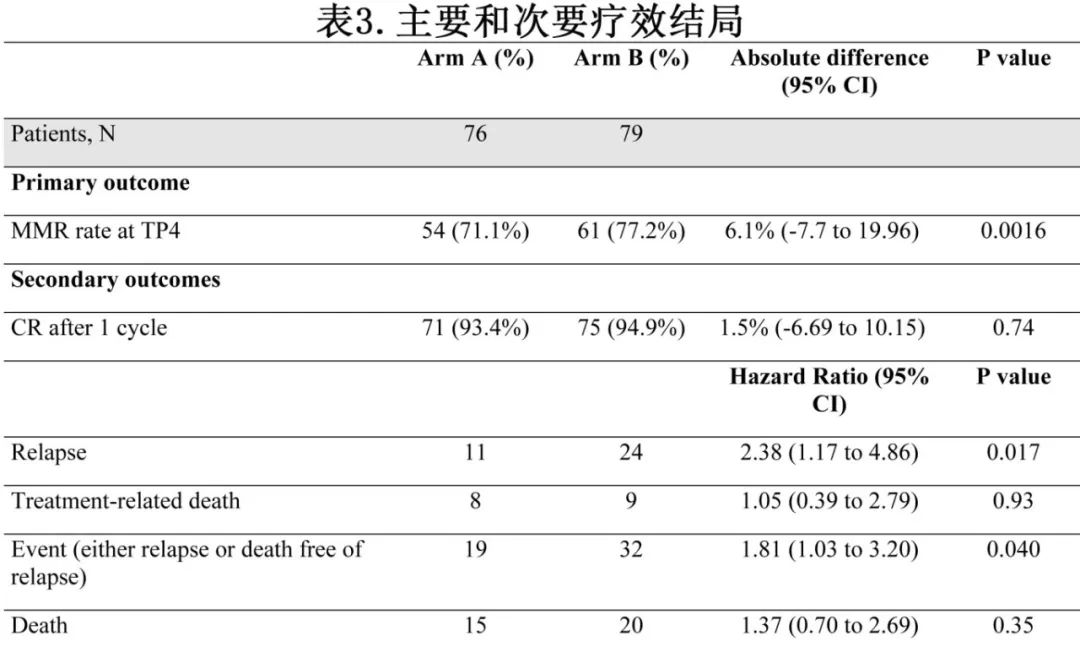
155例患者中的142例(91.6%)接受了全部4个预定周期的治疗,其中135例在第4周期后接受MRD评估;在第4周期后接受或未接受MRD评估的患者特征无差异。在TP4时,155例患者中的115例(74.2%)达到MMR,包括A组的54例(71.1%)和B组的61例(77.2%),减低强度组达到非劣效的主要终点。在主要分析(ITT人群)中,差异为6.2个百分点 (表3)。在基于完整病例的敏感性分析中,MMR率的差异为2.8%。
次要终点
除3例早期死亡的患者外(A组2例[第10和18日],B组1例[第22日]),其余患者均达到血液学CR;A组总体血液学CR率为97.4%,B组为98.7% (p=0.61)。刨去第1周期早期死亡的3例患者,除6例患者外(两组各有3例患者在第2周期后达到CR),患者均是在第1周期后均达到血液学CR;A组1个疗程后的CR率为93.4%,B组为94.9% (p=0.74)。从第1到第4个周期,两组的MMR缓解率均无差异,随机分组后60日或120日的早期死亡也是如此,唯一的显著差异为A组患者在第2周期后为CMR的患者比例较低(p=0.031)。
ITT人群平均随访46个月,52例患者发生事件,包括35例复发(A组11例,B组24例,各有1例CNS复发)和17例非复发死亡 (分别有8例和9例)(图2和表3)。B组4年累积复发率显著高于A组(31.3% vs 13.2%,原因特异性风险比[HR]=2.38,p=0.017;图2a)。两组的NRM累积发生率无统计学差异(SHR=1.05,p=0.88;图2b)。

35例复发患者中29例检测了BCR::ABL1酪氨酸激酶区(TKD)突变,20/29(69%)至少有1种突变,其中10/20(50%)为T315I突变
A组和B组的4年OS率分别为79.4%和73.4%,无显著差异(HR=1.37,p=0.27;图2c)。B组的RFS显著短于A组(58.5% vs 76.2%,HR=1.81, p=0.029)(图2D)。
正如预期,B组在第2和第4个周期的血液学毒性较低,ANC< 0.5x109/L和血小板<20 x109/L的患者数量较少;这与周期2的感染发生率较低相关,但与周期4的感染发生率无关。
共133例患者接受SCT,包括93例异基因移植(A组46例和B组47例)和40例自体移植(A组19例和B组21例)。两组之间的唯一差异在于B组从CR到SCT的时间短于A组(p=0.007)。
allo-SCT后,两组患者的CIR (HR=1.46)、NRM (HR=1.00)、RFS (HR=1.20)和OS (HR=1.15)均无差异。另一方面,auto-SCT后4年CIR方面,A组为26.3%,B组为53.2% (p=0.11),并转化为RFS差异 (41.5% vs 73.7%,p=0.066)。
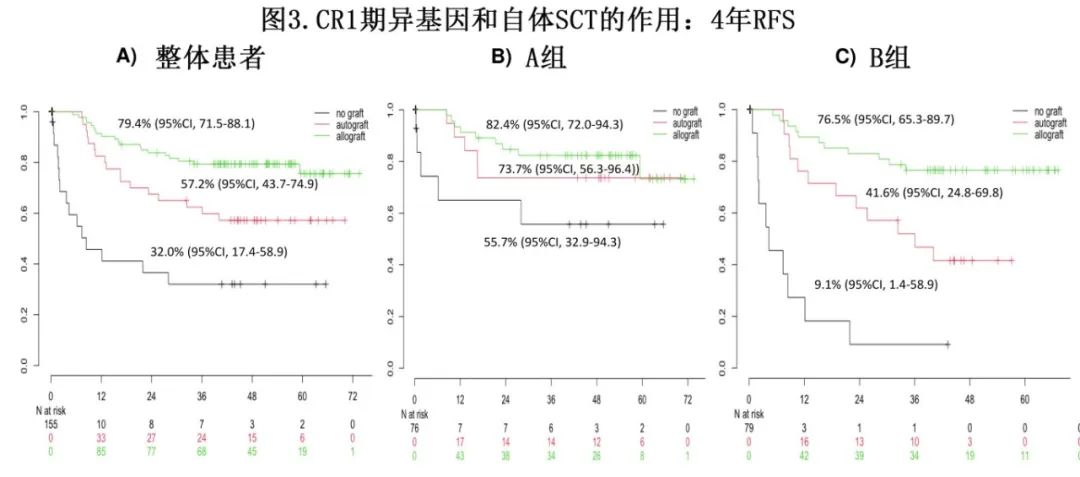
对于整体患者,在时间依赖性分析中,allo-SCT相对于自体SCT(HR=0.46,P=0.018)和未移植队列(HR=0.17,P=0.0001)具有较长RFS,4年RFS率:allo-SCT 79.4%,auto-SCT 57.2%,未移植队列32.0%(图3A)。在B组中也观察到类似差异(分别为HR=0.35,p=0.011和HR=0.08,p=0.0001,4年RFS分别为76.5%、41.6%、9.1%(图3C)。然而在A组中,allo-SCT后的RFS改善仅与未移植队列相比显著(HR=0.3,p= 0.045),但与自体SCT相比无显著差异(HR=0.73,p=0.57), 4年RFS分别为82.4%、73.7%、55.7%(图B);需要注意的是,自体移植后只有1例移植相关死亡,而7例死亡发生于复发后。
事后分析
比较了p190 (m-bcr)或p210转录物(M-bcr)的Ph+ ALL患者的预后,两组的OS (p=0.68)、和RFS (p=0.81)均无差异。
在接受allo-SCT的患者中,TP4的MMR对RFS没有影响,MMR患者4年RFS为82.1%,而非MMR患者为72.0% (p=0.30);两组的4年RFS也无差异,分别为87.3%和76.7% (p=0.90)。
清髓性预处理(MAC)和减低毒性预处理(RTC)方案对allo-SCT患者的影响,没有观察到差异,特别是MAC和RTC后4年的NRM分别为12%和9.5% (p=0.74),CIR分别为9.9%和9.6% (p=0.86)。
总结
随机GRAAPH-2014研究使用尼洛替尼,并解决了巩固治疗中未使用阿糖胞苷(Ara-C)的问题。在155例可评估的患者中,77例在巩固治疗期间接受Ara-C治疗(A组),78例未接受Ara-C治疗(B组)。总体而言,133例(85%)患者接受SCT, 93例为异基因,40例为自体。达到MMR非劣效性终点的患者分别为71.1% (A组)和77.2% (B组),但B组的4年累积复发率高于A组(31.3% vs 13.2%,P=0.017),意味着较低的无复发生存率。中位随访3.8年,A组的4年OS率为79.0%, B组为73.4% (p=0.35)。尽管B组的MMR不劣于A组,但在不影响生存的情况下观察到更多的复发率。
该研究表明,减低强度诱导方案联合二代 TKI,序贯 TKI 常规巩固治疗和 allo-SCT 强化治疗,可获得较高CR率,4年总生存率为80%左右,且与BCR::ABL1 MRD状态无关。该研究结果是否会受到不使用allo-SCT的“无化疗”方案的挑战,还取决于进行中的试验的长期结果和一线治疗中T细胞衔接器的可用性。
参考文献
Chalandon Y, et al. Nilotinib with or without cytarabine for Philadelphia positive acute lymphoblastic leukemia.Blood . 2024 Mar 7:blood.2023023502. doi: 10.1182/blood.2023023502
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#尼洛替尼# #化疗# #阿糖胞苷# #急性淋巴细胞白血病#
21