BRAF V600E及非V600E晚期非小细胞肺癌,一线免疫联合化疗有潜力?
2024-03-03 苏州绘真医学 苏州绘真医学
本研究结果表明,与后线治疗相比,免疫联合化疗方案作为初始治疗可能改善BRAF突变NSCLC患者的OS。
免疫检查点抑制剂(ICIs)联合化疗治疗BRAF突变非小细胞肺癌(NSCLCs)的有效性尚未得到充分探索。研究者收集了306例已确定BRAF突变的NSCLC患者的数据,通过客观缓解率(ORR)和疾病控制率(DCR)来评估疗效,并通过无进展生存期(PFS)和总生存期(OS)来评估生存。
在这些患者中,44例接受了免疫联合化疗方案治疗。接受ICI联合化疗的患者中位PFS为4个月,中位OS为29个月。与接受后线治疗的患者相比,接受一线治疗的患者OS显著较长(29 vs 9.75个月,p=0.01),然而,PFS情况并非如此(9 vs 4个月,p=0.46)。接受ICI治疗的患者ORR为36.3%。在BRAF-V600E突变患者和非V600E突变患者之间,PFS和OS率没有显著差异(分别为p=0.75和p=0.97)。此外,研究者发现对治疗有反应和无反应患者之间的PD-L1表达存在显著差异(p=0.04)。
本研究结果表明,与后线治疗相比,免疫联合化疗方案作为初始治疗可能改善BRAF突变NSCLC患者的OS。需要进一步的研究来验证这些结果,并更深入地研究BRAF突变的特定亚型和PD-L1表达水平如何预测NSCLC患者对治疗的反应。
研究背景
非小细胞肺癌(NSCLC)的治疗方式已取得显著进展,进入精准医学时代。最新进展包括针对表现出特定基因变异(如EGFR突变、ALK和ROS1融合、BRAF V600E突变、MET外显子14跳跃突变、RET融合、HER2扩增和NTRK融合)的肿瘤量身定制的靶向疗法。这些创新疗法显著提高了晚期NSCLC患者的总生存(OS)率。尽管这些药物疗效高,但耐药性的出现是不可避免的障碍,对疾病的治疗构成挑战。
BRAF是一种在细胞质中发现并由BRAF基因编码的丝氨酸/苏氨酸蛋白激酶。这种激酶是RAS通路的重要组成部分,在多种激酶的调节中发挥核心作用,包括MEK1/2和ERK1/2,这些激酶对细胞信号传导、增殖和生存至关重要。虽然BRAF突变有助于BRAF激酶的持续激活,但在NSCLC中相对较少发生。只有约2%的肺腺癌患者有BRAF突变,BRAF突变更常见于从不吸烟者、女性以及具有微乳头型等侵袭性组织学类型的患者。BRAF突变分为三种不同的类型:BRAF V600E,称为I类或经典突变,以及非V600E突变,包括II类和III类突变。BRAF V600E突变是NSCLC中最常见且临床上可干预的突变。一般来说,这种突变是排他性的,不会与其他致癌驱动基因一起发生。在极少数情况下,BRAF突变可能与KRAS基因等其他突变同时发生。
铂类双药化疗在治疗有BRAF V600E突变的晚期NSCLC患者方面仅取得了一定程度的成功。这些患者的客观缓解率(ORR)较低,并且这些铂类药物并没有显著改善其生存结局。研究表明,BRAF突变的NSCLC患者可能从BRAF抑制剂治疗中获益。然而,BRAF V600E突变的NSCLC患者接受BRAF抑制剂单药治疗后的缓解情况并不理想,ORR范围为33%-42%,中位无进展生存期(PFS)仅为5.5-7.3个月。相比之下,同时靶向BRAF和MEK抑制剂的联合治疗显示出了更大的前景,ORR为63%-64%,中位PFS为9.7个月。当作为一线治疗时,患者的OS平均延长至24.6个月。然而,在非V600E BRAF突变患者中未观察到这些改善。尽管靶向BRAF抑制剂具有潜力,但其高成本和来自中国患者人群的数据稀缺限制了其在中国的广泛应用,因此大多数携带BRAF V600E突变的中国患者无法获得这些药物。因此,对于BRAF突变的NSCLC患者,迫切需要更容易获得和有效的治疗方案。
免疫检查点抑制剂(ICIs)彻底改变了NSCLC的治疗策略,特别是对于缺乏驱动基因突变的患者。然而,有证据表明,ICIs对EGFR或ALK突变的NSCLC患者疗效较差。ICIs对BRAF突变NSCLC患者的疗效尚未完全确定,一些较小的研究表明,在这一亚组中ICIs作为单药治疗时,其疗效有限,这一发现引发了一些争议。一份特殊病例报告强调了1例携带BRAF V600E突变的NSCLC患者在接受ICIs和化疗联合方案后获得了长期的有益应答。这表明ICIs联合化疗可能是治疗BRAF突变NSCLC的一种有前景的方法。因此,为这一患者人群确定最佳的初始全身治疗仍是一项正在进行的努力。
在这项研究中,研究者回顾性分析了44例晚期BRAF突变NSCLC患者的结局,这些患者接受了免疫检查点抑制剂和化疗的联合治疗。本分析的重点是通过分析PD-L1表达水平、肿瘤突变负荷(TMB)、治疗线和BRAF突变的具体类型等因素来评估联合治疗的有效性。
研究结果
患者人口统计数据:
研究者对2014年7月1日至2021年12月1日在郑州大学第一附属医院接受治疗的晚期NSCLC患者的数据进行了广泛的回顾。共有306例患者被诊断为BRAF突变NSCLC。确诊时分期:I期85例,II期3例,III期40例,最大组IV期175例(详见表1)。在确诊的患者中,28例患者(9.5%)在首次发现转移性疾病时已出现脑转移。最常见的诊断是腺癌,占93.8%,队列中的很大一部分患者(n=222,72.5%)要么从不吸烟,要么有轻度吸烟史(少于10包/年)。年龄范围27-98岁,中位年龄64岁,符合BRAF突变NSCLC患者常见的临床特征。与过去的报道相似,研究者发现KRAS突变是与BRAF最常见的共发生突变。在该队列中,21例患者同时携带KRAS和BRAF突变。在这一亚组中,11例患者除BRAF突变外,还存在EGFR致敏突变,包括外显子19的缺失和外显子21的L858R突变。值得注意的是,一名患者同时存在BRAF突变和ALK融合,而另一名患者则同时存在BRAF突变和CCDC6-RET融合。BRAF基因突变检测方法多样,其中76.4%(234例)采用NGS检测,22.2%(68例)采用PCR检测。4例(1.3%)同时采用了NGS和PCR方法。最常见的突变是BRAF V600E,共195例(63.7%)。研究者还筛查了其他BRAF突变,统称为非V600E突变,如G469A和K601E突变(图1)。
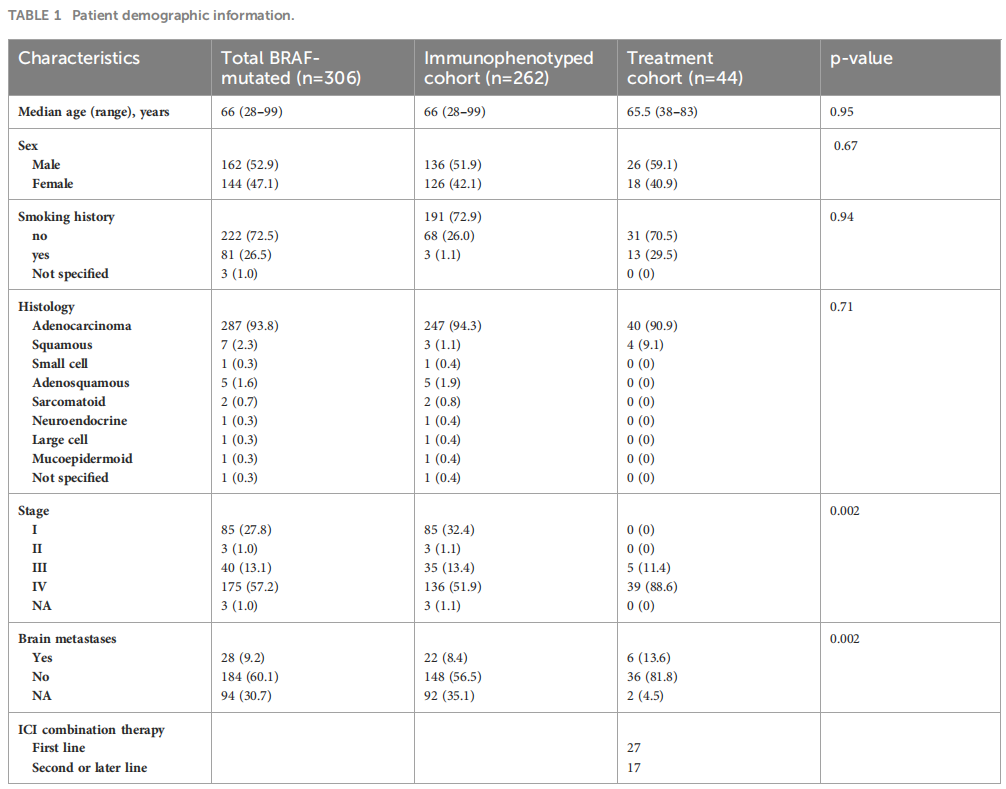
表1
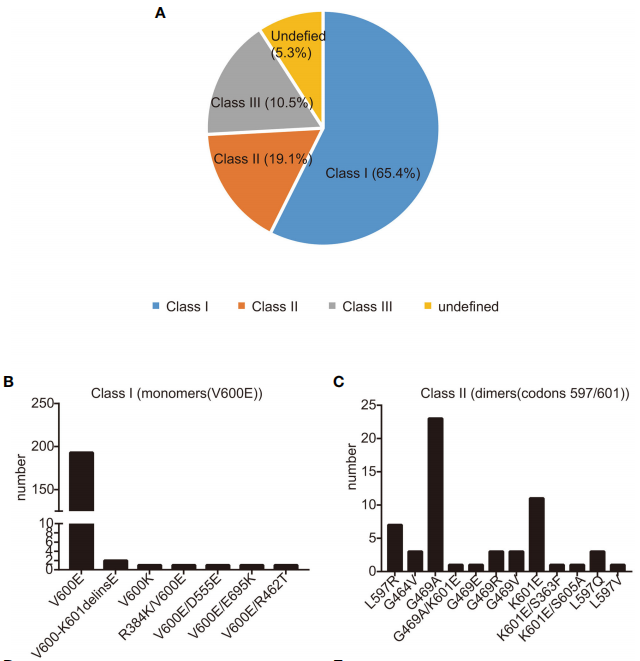
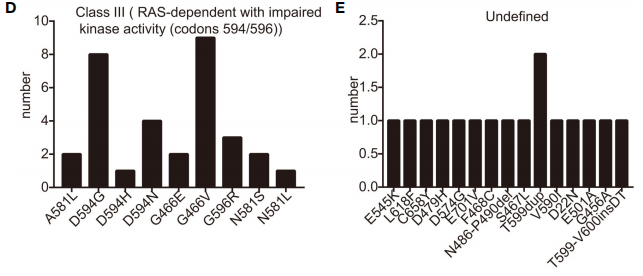

图1
免疫表型:
研究者在163例诊断为BRAF突变NSCLC的患者中评估了PD-L1表达,其中包括来自治疗队列的43例和具有特征性免疫特征的120例患者。分析显示,89例患者(54.6%)PD-L1表达阴性,52例患者(31.9%)PD-L1低表达,22例患者(13.5%)PD-L1高表达(表2)。38例BRAF突变患者有可获得的TMB数据,该亚组包括治疗组的11例患者和免疫表型组的27例患者。在这一人群中,28例患者的TMB低于10mut/Mb,占73.7%,另外10例患者(26.3%)的TMB≥10mut/Mb(表2)。为了进行一致的比较分析,研究者只关注同时使用MSK-IMPACT panel(一种广泛使用的基因组分析平台)进行NGS检测和TMB分析的患者。研究者计算出BRAF突变肺肿瘤的中位TMB为6.3mut/Mb,范围为0-27.92mut/Mb。

表2
疗效:
这项研究包含44例接受ICIs联合化疗方案治疗的患者。在该队列中,25例患者将联合治疗作为一线治疗,其余19例患者在后线治疗中接受了联合治疗。截至数据截止点,在15例可评估疗效的患者中,研究者观察到的ORR为35.7%(95%CI:20.6-50.8%)。具体而言,一线治疗组ORR为40.7%(95%CI:20.9-60.5%),二线及以上治疗组ORR为29.4%(95%CI:5.3-53.6%),但差异没有统计学意义(p=0.53)。一线治疗组的DCR较高,为77.8%(95%CI:61.0-94.5%),后线治疗组为58.8%(95%CI:32.7-84.9%)(p=0.31) 。如图2A所示,研究者确定的中位PFS为4个月(95%CI:3.74-4.26)。所有接受ICI的患者的OS为29个月(95%CI:26.8-31.2),如图2B所示。在进行亚组分析时,研究者发现初始接受联合治疗的患者与后线接受治疗的患者相比,有较长的中位PFS(9个月vs 4个月,p=0.46),如图3A所示。此外,在一线治疗中开始联合治疗的患者中位OS显著高于在后续治疗中开始联合治疗的患者(29个月vs 9.75个月,p=0.01),见图3B。已知BRAF V600E突变患者对BRAF靶向治疗有积极反应,而非V600E突变患者则相反。在本研究中,V600E突变患者的ORR为40%(95%CI:19.4-60.6%),而非V600E突变患者的ORR为31.6%(95%CI:8.6-54.6%)。此外,根据PD-L1表达水平和BRAF突变类型分类的靶病变直径的最显著变化见图3C、D。携带V600E突变患者的中位PFS为6个月,非V600E突变患者为8个月,但差异无统计学意义(p=0.67,HR=0.75,95%CI:0.37-1.52)。此外,两个突变组的OS没有观察到差异(p=0.97,HR=1.02,95%CI:0.41-2.53)。
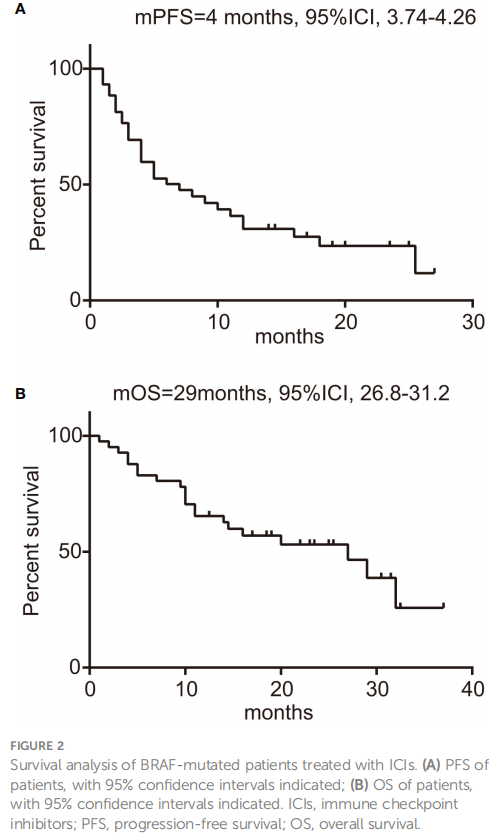
图2
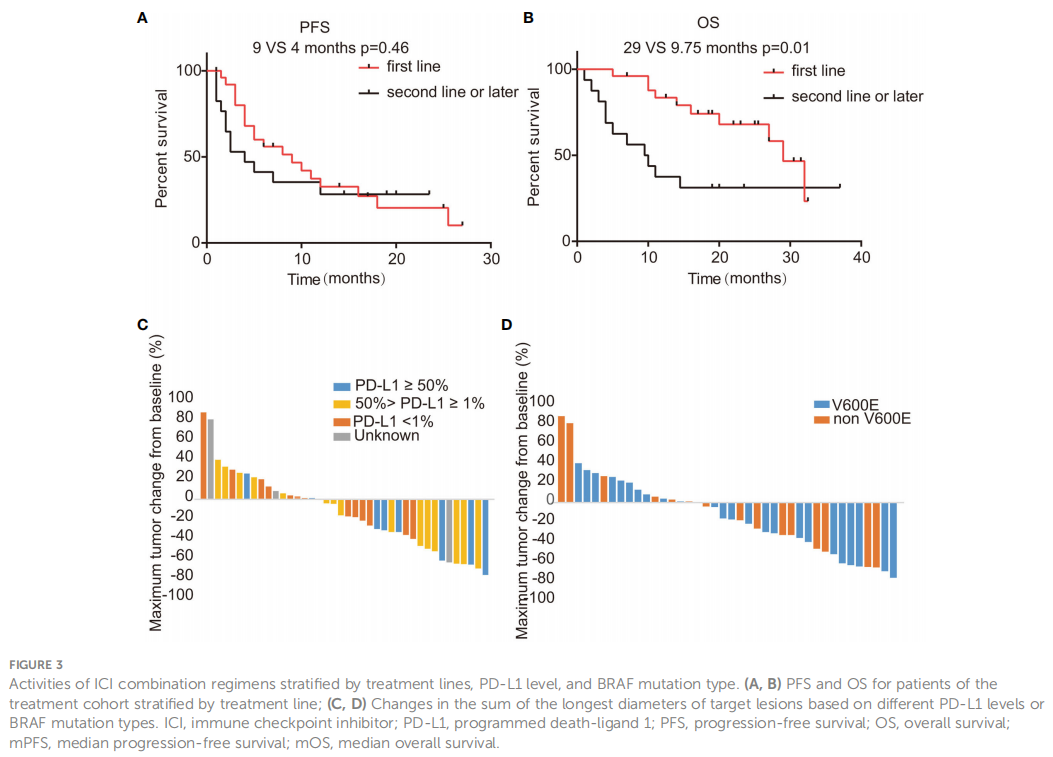
图3
ICI疗效与PD-L1和TMB的相关性:
之前的研究已经确立了PD-L1表达、TMB和ICIs疗效之间的联系。在本研究中,研究者进一步探索了BRAF突变NSCLC中这些潜在的预后生物标志物。本研究结果表明,PD-L1表达水平与ICIs的应答显著相关,具体而言,有应答者(达到PR的患者)的中位PD-L1表达水平为38%,而无应答者(SD或PD)的中位PD-L1表达水平为16%,p值为0.04(如图4A所示)。相反,在比较TMB水平时没有观察到这种相关性(中位数:6.5 vs 11.5mut/Mb,p=0.22),如图4B所示。此外,PD-L1表达≥1%的患者PFS较长,平均为9个月,而PD-L1表达< 1%的患者为4个月,但这一结果无统计学意义(p=0.46)。但研究者观察到OS显著改善,PD-L1表达≥1%的患者中位OS为29个月,PD-L1表达< 1%的患者中位OS为9.75个月(p=0.01)。当将TMB与PFS或OS进行比较时,无显著差异。同样,靶病灶总数的最大减少与PD-L1水平(r=-0.02,95%CI:-0.42-0.37,p=0.90,如图4C所示)或TMB(r=0.41,95%CI:0.29-0.83,p=0.23,如图4D所示)之间也没有显著相关性。
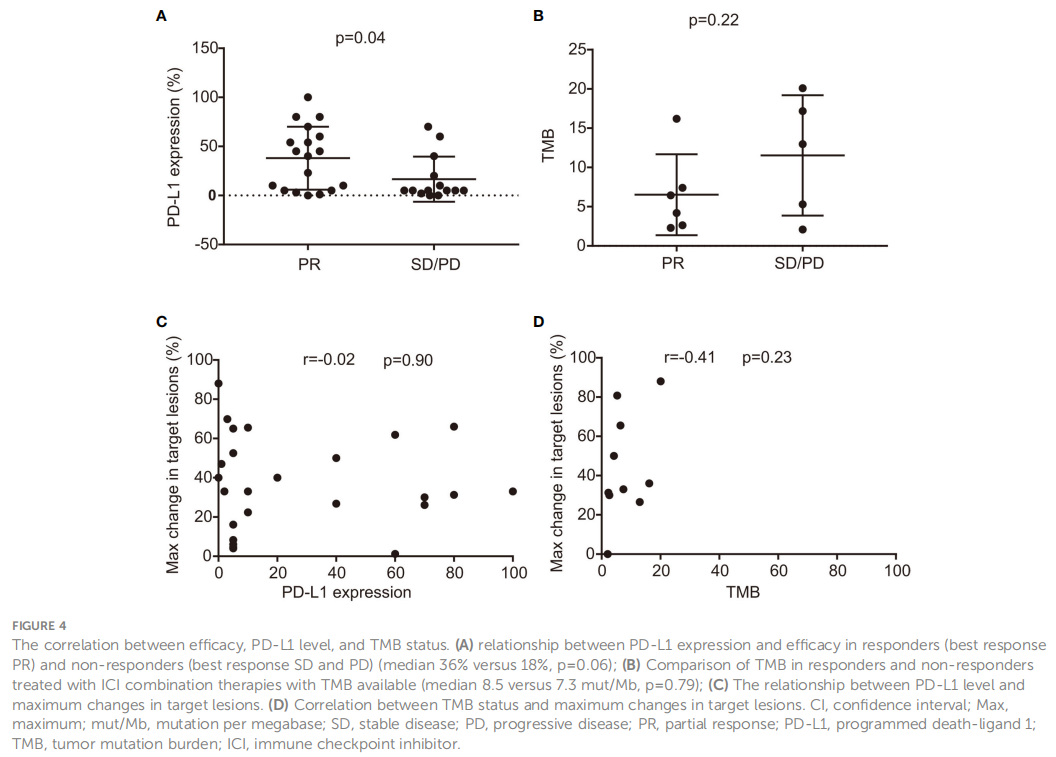
图4
不良事件:
在接受ICI联合治疗的患者亚组中,有30例患者发生了不良事件。对于接受这些治疗的BRAF突变患者,不良反应一般耐受性良好。最常见的不良事件与血细胞计数相关:中性粒细胞减少发生于16.6%的患者,贫血发生于36.7%,血小板减少发生于14.3%。值得注意的是,这些血液学不良事件的严重情况(3级或更高级别)相当罕见,中性粒细胞减少、贫血和血小板减少的严重情况分别为0%、0%和3.3%。30%的患者(共9人)出现轻度肝损伤。3例患者出现间质性肺病,其中1例患者因此停止治疗。其他副作用包括影响胃肠道系统、皮肤和发生甲状腺功能减退等。
讨 论
据研究者所知,这项回顾性分析代表了研究中国BRAF突变NSCLC患者的免疫表型以及免疫治疗与化疗相结合的影响的开创性努力。研究结果表明,这类肺癌可能对免疫联合化疗疗法产生积极反应,这与其他地区之前的数据一致。然而,由于这是一项回顾性研究,且患者队列规模较小,研究者建议进行更多研究来证实这些初步结果。
既往研究提示,BRAF突变患者的PD-L1表达往往较高。与此相反,本研究观察到,大多数BRAF突变患者的PD-L1表达水平低(≤50%),这似乎对之前的报告提出了挑战。对较小队列进行的回顾性研究表明,BRAF突变患者有PD-L1阳性表达模式。例如,一项针对29例BRAF突变NSCLC患者的研究发现,约69%(20/29)的患者显示PD-L1阳性表达,超过40%的患者PD-L1水平≥50%,表明这一人群中存在相当多的PD-L1阳性患者。然而,在更大规模的本文研究中,研究者发现只有14.7%(22/150)的患者PD-L1表达水平≥50%。与早期研究相比,观察到的差异可能与本研究样本量较大有关。此外,本文数据显示,大多数患者的TMB较低,中位值为6.3mut/Mb,这与BRAF突变NSCLC患者可能倾向于具有较低或中等的TMB和微卫星稳定性的观点一致。在本研究中,大多数携带BRAF突变的患者被发现为从未吸烟者,这些患者要么从未吸烟,要么在20多年前戒烟。先前的研究表明,吸烟史通常与较高的TMB相关,这可以解释本文研究者在BRAF突变NSCLC中观察到的较低TMB。此外,值得注意的是,低TMB是有其他类型致癌驱动突变的NSCLC患者的一个常见特征。这可能解释了为什么肿瘤驱动型癌症患者接受ICI治疗后通常只有中等程度的缓解。另外,本研究数据显示,一些携带BRAF突变的患者还携带其他致癌驱动基因,如EGFR突变、ALK和RET融合。这与之前认为BRAF突变是这些NSCLC患者的唯一驱动因素这一观点相矛盾。尽管发现了多种致癌驱动基因,但重要的是要强调同时发生的突变相对罕见,其中BRAF最常与KRAS突变同时发生。
既往研究表明,在有致癌驱动突变(如致敏EGFR和ALK变异)的NSCLC患者中,单独使用免疫疗法时,获益通常有限。例如,Garon及其同事的研究表明,未经治疗的EGFR突变NSCLC患者接受ICI帕博利珠单抗治疗后的ORR为50%,中位PFS为5.3个月。这与既往接受过治疗的EGFR突变NSCLC患者的结果形成了鲜明对比,后者的ORR降至4%,中位PFS降至1.9个月。同样,在有ALK、ROS1和RET融合的NSCLC患者中,一项关于ICI单药治疗效果的综合研究发现,最常见的结局是疾病进展。因此,目前的临床指南一般不建议将ICI单药治疗作为携带这些特定突变的NSCLC患者的后续治疗。在有BRAF突变的NSCLC患者中观察到相似的结局。另外有研究结果表明,BRAF V600E突变NSCLC患者接受ICI单药治疗的缓解率约为25%,中位PFS为3.7个月。回顾性研究一致报告,BRAF突变NSCLC患者接受ICI单药治疗的ORR为10%-30%,中位PFS时间为2-4个月。值得注意的是,数据还提示,非V600E BRAF突变的NSCLC患者对ICI的应答可能优于V600E突变的患者。然而,携带V600E突变的患者的总生存期往往较长,这可能是由于针对这种特定BRAF突变的靶向治疗有效。与其他致癌驱动基因的情况一样,ICI单药治疗通常不是BRAF突变NSCLC患者的首选初始治疗。
本研究数据表明,ICIs联合化疗可能是BRAF突变NSCLC患者的一种有前景的治疗方法。尽管ORR为36.3%,但该治疗获得了4个月的中位PFS和29个月的中位OS,这是很有前景的结局,有必要对这一联合治疗进行进一步研究。Lu和同事报道的一个病例详细描述了一例BRAF V600E突变NSCLC患者对免疫联合化疗治疗方案的反应良好,达到了20个月的PFS,为这一观点提供了支持。该病例提供了BRAF V600E突变患者可能从包括ICIs和化疗的治疗策略中获益的早期证据。此外,化疗和免疫治疗的协同作用已被证明可提高无驱动突变的晚期NSCLC患者的生存率,这一发现得到了既往随机试验结果的支持。这些研究强调了免疫联合化学疗法在晚期NSCLC治疗方面取得重大进展的潜力。本研究结果提示,对于BRAF突变NSCLC患者,与ICI单药治疗相比,包括ICI的联合治疗可能是更受青睐的方法。然而,有必要澄清的是,这并不意味着所有携带BRAF V600E突变的患者都普遍更获益于ICI联合方案而不是BRAF TKI。目前的治疗指南仍然优先考虑BRAF V600E突变NSCLC进行BRAF TKI治疗,临床试验数据表明生存结局更好(一线BRAF TKI治疗的中位PFS为14.6个月,在后线治疗中,BRAF TKIs的中位PFS为5-8.6个月)。此外,之前的真实世界数据发现,携带BRAF V600E突变的患者达到了78%的ORR,mOS与本研究相似。然而,该研究仅纳入了17例可评估的患者,因此应谨慎解读结果。因此,治疗选择(包括ICI联合用药或BRAF TKI的潜在应用)应个体化,并考虑到每例患者的独特特征和正在考虑的特定治疗线。此外,鉴于与BRAF TKIs相关的巨额费用,ICI联合治疗可被视为BRAF突变NSCLC患者的可行替代方案,尤其是在治疗后期。
一个值得注意的发现是,似乎只有BRAF V600E突变的NSCLC患者从BRAF靶向治疗中获益,而非V600E BRAF突变的患者往往对BRAF TKIs的疗效较差。本研究观察到,非V600E BRAF突变患者对ICI联合治疗的应答较好,达到了10个月的中位PFS,而BRAF V600E突变患者的PFS为5个月。虽然这些结果没有统计学意义,可能是由于样本量小,但它们提示了一个潜在的趋势。此外,非V600E突变组的ORR高于BRAF V600E组(40.0% vs. 31.6%),这强化了非V600E突变可能更适合ICI联合治疗的观点。这与其他研究的结果一致。值得注意的是,随着NSCLC治疗越来越个体化,ICI联合治疗正成为非V600E BRAF突变患者的重要选择。对于携带较常见BRAF V600E突变的患者,这一治疗策略可能也值得考虑用于后线治疗,这表明ICI联合治疗在这一异质性疾病的治疗领域具有更广泛的意义。
之前的研究表明,PD-L1表达和TMB可能是预测ICIs疗效的有效生物标志物。与这些见解一致,本研究发现PD-L1表达是BRAF突变的NSCLC患者ICI联合治疗成功的可靠预测因素。然而,TMB并未显示出类似的预测能力。与TMB缺乏相关性可能是由于本研究中患者数量相对较少,以及可能使用了不合适的TMB阈值。
本研究面临一些值得关注的重大局限性。首先,本研究的患者数量较少,这可能限制了统计学强度和更广泛应用本研究结果的能力。此外,并非所有研究参与者都接受了PD-L1水平和TMB评估,这导致了潜在的可变性和数据集不完整的问题。此外,接受ICI治疗的患者比例有限,这缩小了研究者的分析范围。这些因素,再加上本研究的回顾性设计和可能的选择偏倚,建议在解读本研究结果时采取谨慎的方法。因此,有必要进行进一步的前瞻性研究来证实本观察结果,并扩展研究者提出的观点。
本研究结果表明,BRAF突变NSCLC患者通常具有较低的PD-L1表达,并且 TMB 处于低至中等范围内。将ICIs与其他治疗相结合的疗法在控制疾病方面显示出了有前景的结果,并且患者的耐受性良好,无论患者携带BRAF V600E突变还是其他类型的BRAF突变。具体而言,有非V600E BRAF突变的患者可能从联合治疗方案中获得更好的结局。此外,使用这些联合疗法作为初始治疗有可能改善BRAF突变NSCLC患者的总生存期。这些见解为研究开辟了新的方向,并强调了治疗这部分NSCLC患者的临床创新潜力。
参考文献:
Yan N, Zhang H, Guo S, et al. Efficacy of chemo-immunotherapy in metastatic BRAF-mutated lung cancer: a single-center retrospective data. Front Oncol. 2024;14:1353491. Published 2024 Jan 31. doi:10.3389/fonc.2024.1353491

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#非小细胞肺癌# #化疗# #免疫检查点抑制剂#
25