免疫治疗在胰腺癌中是否有一席之地?
2017-04-15 Dr. GHL 肿瘤资讯
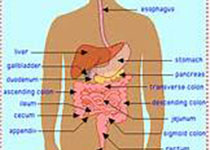
免疫治疗是肿瘤治疗中异军突起的一员,在肺癌、黑色素瘤等实体肿瘤的临床试验中都取得了很好的结果。正是因为其疗效惊人,各研究机制正努力将免疫治疗推广到更多实体瘤中。在“癌中之王”胰腺癌中,由于晚期胰腺癌的化疗药物种类十分有限,仅有吉西他滨、FOLFIRINOX(亚叶酸,5-氟尿嘧啶,伊立替康,奥沙利铂)、白蛋白紫杉醇等几种药物的疗效在临床中得到证实。因此研究者们不约而同的开始探索免疫治疗在胰腺癌中的效
作者:Dr. GHL
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







感谢小编为我们精心准备了如此精辟的精神大餐,小编辛苦了,点个赞吧!
74
这篇文章有点拼拼凑凑嫌疑哦~
0
学习了谢谢分享!!
66
收藏
70
学习!!!!
59