编者按:乳腺癌作为全球女性最常见的恶性肿瘤之一,其诊疗方法经历了从局部外科治疗到全身系统治疗的转变。近年来,随着分子生物学和多组学技术的发展,精准诊疗成为提高乳腺癌治疗效果的关键。在2024南北汇暨第六届乳腺肿瘤论坛上,复旦大学附属肿瘤医院邵志敏教授带来了《聚力分型精准,引领诊疗变革——乳腺癌精准诊疗新模式》的报告,重点分享了在中国原创发展背景下,邵志敏教授团队提出的基于分型精准诊疗的新模式,以及其在临床实践中的应用和展望。【医悦汇】汇总了报告的重点内容,以供交流。
一 乳腺癌诊疗的历史变革
邵志敏教授在报告中指出,乳腺癌诊疗历程经历了多次重要的变革,每一次变革都标志着医学界对乳腺癌认识的深化和治疗方法的进步。
第一次变革:外科治疗
在乳腺癌治疗的早期历史中,乳腺癌被认为是局部区域疾病,外科手术是主要的治疗手段。直到1894年,William Stewart Halsted首次提出了乳腺癌根治术(Halsted术式),这种手术包括乳房全切除和腋窝淋巴结清扫,在随后的几十年中成为乳腺癌治疗的核心术式,并显著改善了患者的生存率和局部复发率。
第二次变革:全身治疗
随着对乳腺癌生物学特性的进一步认识,医学界开始意识到乳腺癌不仅仅是局部疾病,而是一种全身性疾病。这一认识的转变促进了系统性化疗的发展,化疗药物的使用开始成为乳腺癌治疗的重要组成部分,为患者带来疗效的改善。
第三次变革:分型治疗
“一刀切”的全身治疗获益有限,催生分子分型研究。21世纪初,随着分子生物学技术的发展,乳腺癌的治疗进入了分型治疗的时代。Charles Perou教授根据乳腺癌的生物学特征将其分为不同的亚型,如腔面型乳腺癌(Luminal型)、HER2阳性型乳腺癌和三阴性型乳腺癌,而每种亚型则对应了不同的治疗策略,如内分泌治疗、抗HER2靶向治疗和化疗。然而,现有的治疗模式中仅HER2+晚期乳腺癌预后显著改善,其它亚型乳腺癌患者预后的提升相对有限。
第四次变革:分型精准治疗
邵志敏教授认为,未来乳腺癌的治疗模式将走向分型精准治疗。分型精准治疗是指在进一步分子分型的基础上开展精准治疗,有望实现“人群广覆盖,治疗高特异”,可能会改变将来乳腺癌的治疗策略。
二 乳腺癌的分型精准治疗
(一)绘制中国乳腺癌图谱——乳腺癌精准诊疗新模式
邵志敏教授团队研究发现,中国乳腺癌患者具有特异的临床和分子特征,与国外患者存在显著差异。如患病年龄呈双峰分布(45~55岁和65~75岁为2个年龄发病高峰)、绝经前患者较绝经后患者更多,以及中国乳腺癌低外显基因多态性的特点,因此,亟需制定适合中国人群的乳腺癌精准诊疗策略。
目前多组学队列包括TCGA、METABRIC、CPTAC及韩国年轻乳腺癌,以高加索裔人种为主,样本量大,但缺乏大样本中国乳腺癌人群队列研究,同时缺乏大样本完整组学队列(如缺乏大样本蛋白组、代谢组等多组学数据),且既往的队列研究多以绝经前患者为主,年代久远、信息陈旧。因此,现有的多组学结果难以应用于临床。
为了解决这一问题,邵志敏教授团队等联合绘制了中国人群乳腺癌多组学图谱(Chinese Breast Cancer Genome Atlas ,CBCGA)[1],构建了迄今为止最大的中国乳腺癌多组学自然队列,全面揭示了中国乳腺癌分子特征,组学维度齐全,包含临床信息、转录组、基因组、蛋白组、代谢组、影像组和病理组。
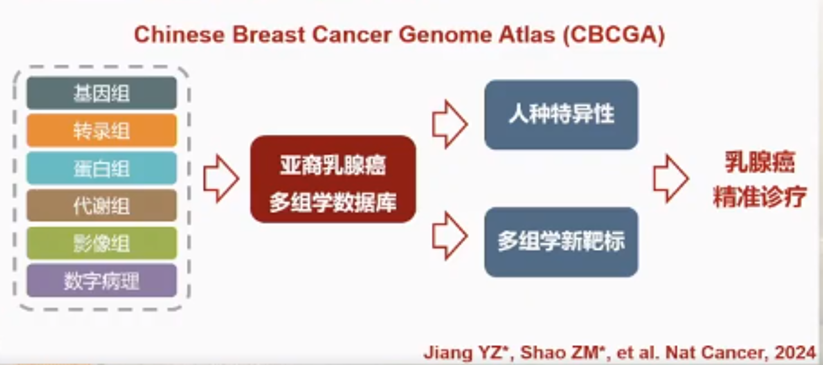
1、数据库价值
中国人群乳腺癌多组学图谱(CBCGA)是目前样本量最大的亚裔队列,也是多组学维度最全的队列,从人种特点来看,CBCGA揭示了亚商乳腺癌独特的多组学特征,并且融合了多组学鉴定临床新线索。
2、人种特征
亚裔乳腺癌特异性分子特点[1,2,3]包括:①中国乳腺癌患者富集AKT1突变(6.4% vs 2.5%,FDR= 0.032);②在乳腺癌各个亚型中,Luminal A型乳腺癌的AKT1突变中外差异最大(12.1% vs 4.4%,FDR=0.025);③AKT1存在热点突变E17K,且具有驱动突变的性质:提示中国Luminal A型乳腺癌更可能从靶向AKT治疗中获益;④在总体人群和HR+HER2+(临床分型)中,中国患者的HER2-enriched亚型(PAM50分型)比例显著高于白人患者;⑤对比PEONY和NeoSphere临床试验结果,中国HR+HER2+乳腺癌对双靶治疗有效率更高,与HR-HER2+乳腺癌疗效差异较小;⑥中国HR+HER2+乳腺癌可能对于抗HER2靶向治疗具有更高的敏感性。
3、临床新线索
蛋白组 CPTAC样本量小,难以分析亚型内部。基于此,CBCGA构建了目前最大的乳腺癌蛋白组队列,系统性分析亚型特异性顺反式效应,揭示肿瘤治疗新靶点。其中,亚型特异性顺式效应提示,WWP1扩增是Luminal B型潜在驱动事件。此外,融合蛋白组学可优化乳腺癌分子分型,鉴定出HR+HER2-乳腺癌中的高危人群。
代谢组 代谢组学分析提示,不同亚型乳腺癌较正常乳腺组织的代谢失调也各有特点,在脂质代谢组层面发现,Basal-like亚型富集铁死亡相关过氧化脂质和蛋白,对铁死亡促进剂更敏感。
免疫组 通过免疫基因组学解析肿瘤微环境发现,根据乳腺癌微环境细胞构成,乳腺癌微环境分型可分为免疫荒漠型、免疫调节型、免疫炎症型,其中,免疫炎症型更可能从免疫治疗中获益,临床中51%的Basal-ike,57%的HER2-enriched和32%的Luminal B亚型为免疫炎症型。
此外,绘制中国乳腺癌融合基因图谱发现,LHFPL5-CLPSL1、GTF21-GTF2IRD1均是新鉴定的融合基因,而ERBB2融合基因可能破坏激酶结构域,提示患者具有较好预后。
影像组和病理组 研究利用人工智能预测分子靶标,研究人员通过融合影像组学和数字病理和基因、转录组等多模态数据对乳腺癌进行复发风险分层。结果显示,在预测乳腺癌复发风险方面,多模态数据的预测模型显著优于单模态数据的预测模型,C-index=0.78。
总体来看,CBCGA建立了最大的亚裔乳腺癌多组学数据库,明确了亚裔人种分子特征,也发现了临床治疗的新线索。
(二)三阴性乳腺癌的分型精准治疗——复旦分型
三阴性乳腺癌(TNBC)的雌激素受体、孕激素受体、人类表皮生长因子受体2(HER2)均为阴性,大约占全部乳腺癌的15%。TNBC不仅恶性程度高、复发转移风险大,还缺少积极有效的治疗手段。因此亟需寻找TNBC中潜在有效的治疗靶点和更精准的分型以开展更精准的治疗。
在这样的背景下,邵志敏教授团队在三阴性乳腺癌人群中开展了分型精准系列研究,形成临床-基础-临床的“闭环”研究体系,基于中国人群不同分子特征和治疗靶点,成功绘制出世界上最大规模的TNBC代谢组图谱,提出三阴性乳腺癌“复旦分型”理念,并在后续研究中持续优化拓展,从代谢组学、苗群与免疫、蛋白组学、铁死亡、关键代谢物及肿瘤内部异质性多个层面不断丰富三阴性乳腺癌“复旦分型”内涵。2023年,三阴性乳腺癌“复旦分型”成功转化,开发出临床实用的分型试剂盒,完成>3000例分型检测,签约合同总价3100万元。
为了验证“复旦分型”在临床实践中的价值,基于“复旦分型”的FUTURE系列重磅研究接连问世。FUTURE试验是基于“复旦分型”开展的伞形临床试验,成功实现基础成果的临床应用转化,使以往“无药可用”的三阴性乳腺癌患者,整体ORR提升3倍,免疫治疗组ORR达43.5%。进一步拓展的FUTURE-C-PIus试验提示,TNBC-免疫调节型(IM)患者一线选择免疫联合抗血管生成治疗,ORR可进一步提升至81.3%(39148),中位PFS提升至13.6个月。FUTURE-SUPER试验是一项针对mTNBC一线治疗的随机对照伞型II期研究,旨在进一步评估基于分子亚型和基因组标志物的精准治疗在mTNBC一线治疗中的疗效。研究主要终点PFS提示,与传统标准治疗方式相比,分型精准治疗策略显著提升患者PFS(中位PFS:11.3m vs 5.8 m,HR =0.44,P< 0.0001)。
FUTURE系列临床试验陆续开展,实现了三阴性乳腺癌“复旦分型”的精准全覆盖,并通过精准分型治疗大幅提升患者的疗效,显著改善患者的疗效,这也是三阴性乳腺癌“复旦分型”的优势所在。总结三阴性乳腺癌“复旦分型”,三阴性乳腺癌分型精准临床试验的疗效明显优于既往临床试验结果,因此,当前对于分型精准的思路是正确的,且在三阴性乳腺癌中取得成效。不足之处在于,未快速开展Ⅲ期随机对照研究,目前还难以改变临床实践。未来,随着FUTURE系列的多个Ⅲ期临床研究成果的陆续发布,期待能让三阴性乳腺癌的精准治疗取得进一步突破。
(三)腔面型乳腺癌的分型精准治疗
邵志敏教授在报告中指出,腔面型(Luminal型)乳腺癌患者占比最高,占全部乳腺癌的70%左右。这类患者治疗手段多,内分泌治疗疗效显著,但复发风险长期存在,术后十年甚至更长时间仍有相当比例出现复发。腔面型乳腺癌目前的治疗模式为延长内分泌治疗时间或针对整体人群开展精准治疗。然而由于分子本质不明,治疗不够精准,以至于疗效提升有限。因此亟需优化治疗模式。
第一步:分子分型精准施策
为了优化Luminal型乳腺癌的精准治疗,邵志敏教授团队聚焦Luminal型乳腺癌关键临床问题开展研究,构建了HR+HER2-乳腺癌多组学队列,包括基因组、转录组、代谢组以及单细胞四个维度,包括478例自然队列样本和101例挑选的复发转移患者的原发灶样本。最终研究人员将腔面型乳腺癌分为SNF1经典腔面型(24.5%)、SNF2免疫调控型(25.4%)、SNF3增殖型(33.6%)及SNF4 RTK激活型(16.5%),临床可根据患者的不同亚型开展精准治疗。
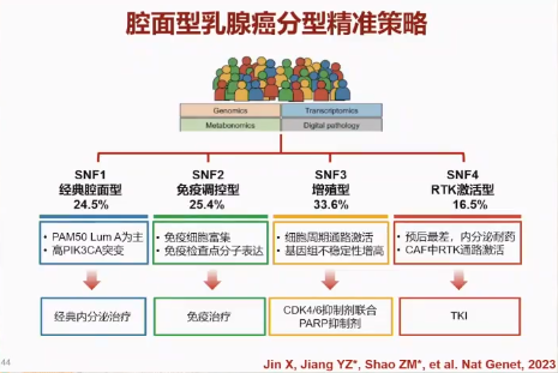
第二步:人工智能转化落地
邵志敏教授团队在前期开展人工智能联合数字病理、影像组学研究,快速、准确的实现三阴性乳腺癌“复旦分型”和靶点可视化,并两次获得国家自然科学基金重大研究计划资助。此外,还基于深度学习等人工智能技术,设计算法框架并构建预测模型,并基于数字病理图像快速、准确鉴定腔面型乳腺癌分子分型。
第三步:通力合作开展临床研究
邵志敏教授团队成立了多中心乳腺癌精准治疗协作组(BCTOP),旨在基于精准医学理念,开展乳腺癌多中心临床研究,推广转化研究平台,开发新型药物和新型技术,提高我国乳腺癌诊治水平和国际地位。
BCTOP多中心通力合作,多维度开展临床研究,验证腔面分型精准治疗疗效。
包括在真实世界开展研究,构建2014-2021年多中心晚期腔面型乳腺癌真实世界队列,回顾性验证SNF分型与临床病理学特征、预后以及疗效的关系,提示相比于腔面型乳腺癌早期队列,多中心晚期队列中,SNF1型占比显著减少,验证SNF1不易复发转移;SNF4型占比显著增加,验证SNF4的内分泌耐药和不良预后。多中心真实世界队列分析分子分型与临床疗效提示,SNF3对CDK4/6i敏感,SNF4对TKI治疗敏感。目前,全面拓展前瞻性临床试验不断开展,晚期二线平台已经初见疗效,例如:在CDK4/6i治疗进展的人群中,分型精准治疗疗效明显优于传统治疗。
总结:由于乳腺癌具有异质性,因此当前乳腺癌的临床治疗还存在一系列问题,现有的治疗策略也需进一步优化。邵志敏教授团队的工作表明,通过分子分型和多组学分析,多中心协作开展作临床研究,在分子分型基础上进行精准治疗,可以为乳腺癌患者提供更为精准的治疗方案。最后,邵志敏教授认为,分型精准治疗理念引导下的乳腺癌治疗,有望引领乳腺癌诊疗模式的新一轮变革。
作者:医悦汇
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#乳腺癌# #精准诊疗#
19