Nature:胶质母细胞瘤进展,新途径可避开血脑屏障,显著延长生存期!
2020-01-19 Ruthy 转化医学网
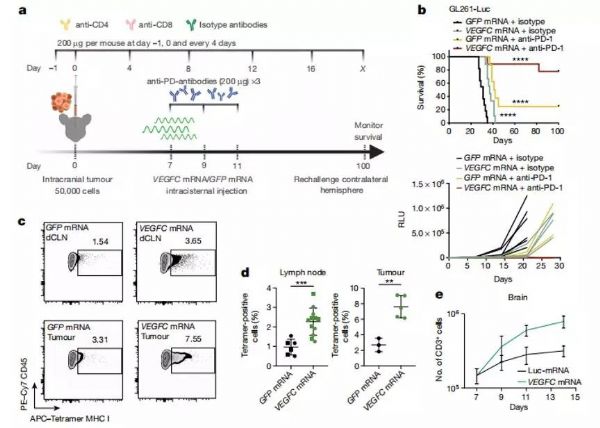
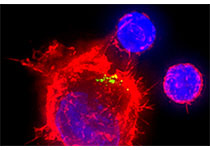
导 读:胶质母细胞瘤(GBM)是最为常见且难以治愈的原发性脑部肿瘤,患者术后预后普遍不佳,即使有放疗相助,患者5年生存率仍然低于10%。肿瘤免疫治疗的发展给多种不治之症的治疗带来了新希望,但大脑独特的免疫环境将大多数治疗药物拦截在外,导致该疗法在GBM治疗领域裹足不前。
作者:Ruthy
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#新途径#
75
#胶质母细胞#
61
#母细胞瘤#
58
#Nat#
70
#血脑屏障#
62