复旦大学蒋晨教授团队《AM》:多肽-药物偶联物递释系统唤醒休眠胶质细胞治疗阿尔茨海默病
2024-10-03 BioMed科技 BioMed科技
本研究摒弃了传统以神经元为核心的脑部疾病治疗策略,展示了一种调控休眠胶质细胞治疗AD的新方法。同时,该研究提供了一种PDC靶向递送的新策略,为疾病的多靶点治疗提供新的思路。
阿尔茨海默病(AD)是一种进行性的神经系统退行性疾病,然而目前缺少有效抑制其进展的治疗手段,使其成为临床上最为难治的脑部疾病之一。近期研究表明,脑内微环境中细胞的表型及代谢功能等与AD的进程高度相关。针对AD微环境阶段性变化的特征来设计治疗策略具有重要的意义。
在前期工作中,蒋晨教授团队针对AD早期炎症微环境设计了一种多肽药物偶联物(PDC)。该PDC以神经元维持自身氧化还原平衡关键靶点Nrf2和微环境中高水平的活性氧(ROS)为切入点,借助PDC为工具高效递送Nrf2激活多肽入脑,从而实现神经保护、小胶质细胞转型和缓解神经炎症的目的。相关研究于Advanced Materials发表(https://onlinelibrary.wiley.com/doi/10.1002/adma.202100746)。然而,AD的早期诊断仍是一个巨大的挑战,且目前缺乏针对大多数中晚期AD患者的有效治疗策略。
因此,在本项研究中复旦大学药学院蒋晨教授团队基于前期对PDC的研究基础,构建了一种PDC共递送平台。首先合成了偶联胶质细胞调控药物的两种PDC,通过静电吸附和共价交联的方式搭载于聚多巴胺(PDA)纳米粒表面。经静脉注射后,该递送平台通过转胞吞作用跨过BBB,在脑内炎症微环境中解离并释放两种PDC靶向胶质细胞。羟基氯喹(HCQ)被靶向递入小胶质细胞,激活免疫反应并恢复能量代谢。而全反式维甲酸(ATRA)被靶向递入星形胶质细胞,促进其转分化,同时减轻炎症水平。本研究摒弃了传统以神经元为核心的脑部疾病治疗策略,展示了一种调控休眠胶质细胞治疗AD的新方法。同时,该研究提供了一种PDC靶向递送的新策略,为疾病的多靶点治疗提供新的思路。该研究以题为“A Peptide-Drug Conjugate-Based Nanoplatform for Immunometabolic Activation and In Situ Nerve Regeneration in Advanced-Stage Alzheimer's Disease”的论文发表在最新一期《Advanced Materials》上。

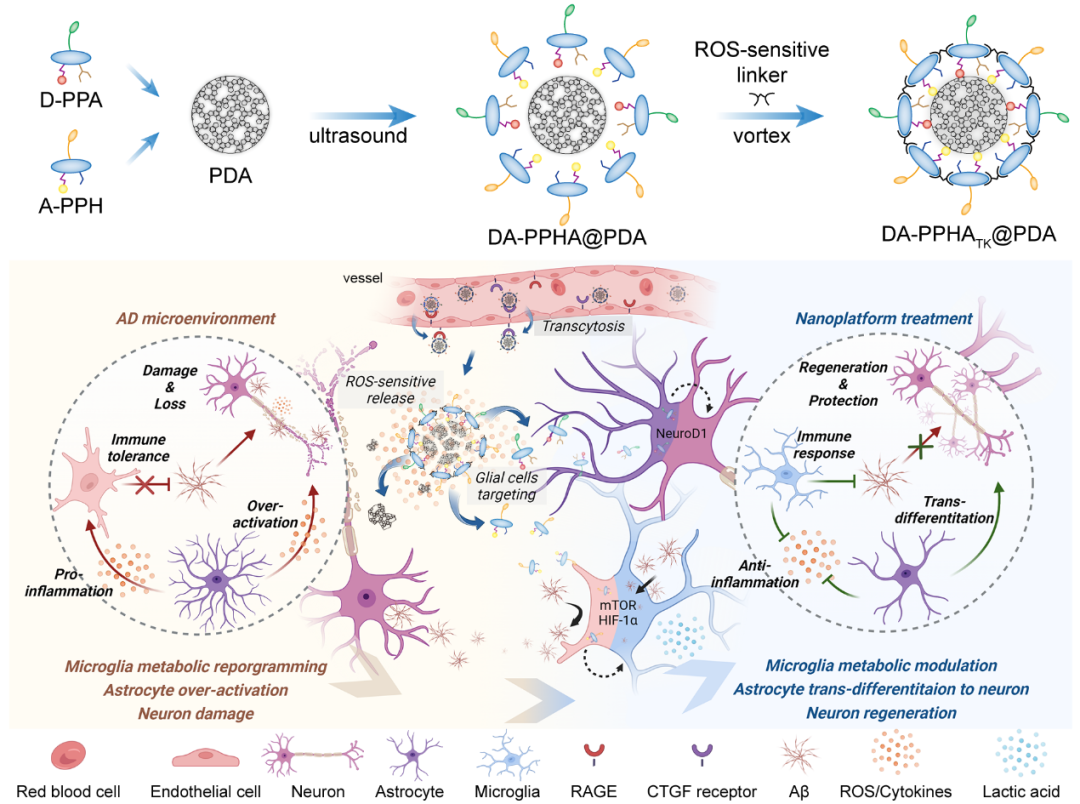
DA-PPHATK@PDA共递释系统的制备过程及调控休眠胶质细胞机制的示意图
【文章要点】
该递送系统呈现球形结构,粒径约为75 nm左右。经体内外实验验证,DA-PPHATK@PDA能够选择性靶向胶质细胞,激活小胶质细胞代谢-免疫网络,促进毒性蛋白降解;推动星形胶质细胞干性激活,原位产生成熟功能性神经元。此外,在递送系统制备过程中意外发现交联剂的加入能够诱导FRET效应产生,从而实现AD转基因小鼠脑内炎症诊断。
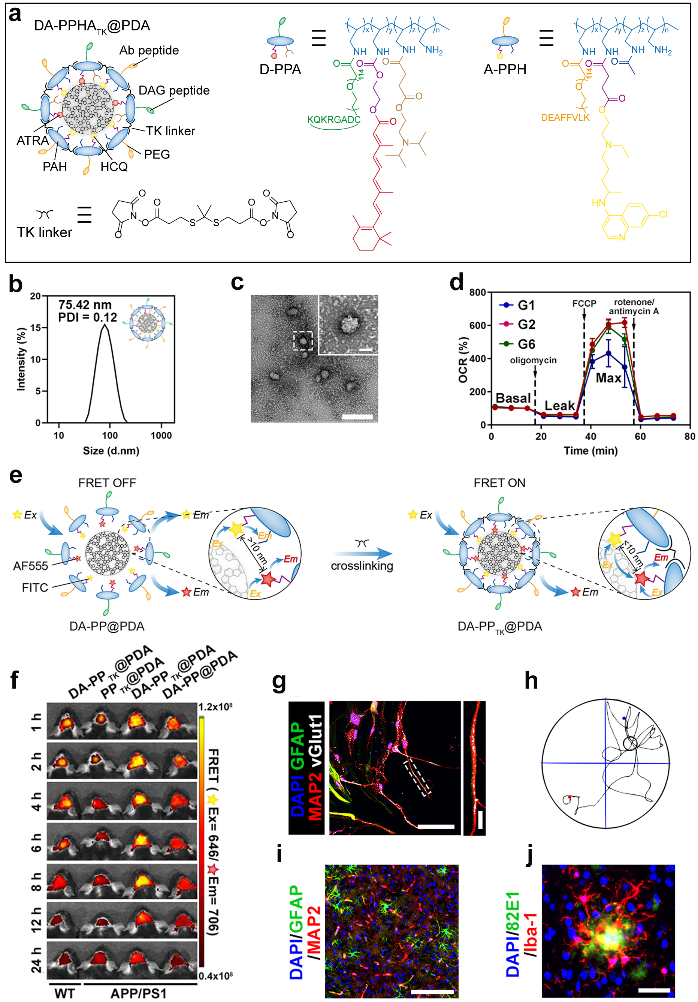
DA-PPHATK@PDA结构示意图及其体内外调控效果
【总结与展望】
目前AD治疗仍面临着很多挑战,其原因可能是发病机制复杂且未明、异质性较强且会伴随其它疾病的发展。越来越多的研究表明,多靶点协同治疗对于AD具有重要意义。该项研究所提出的PDC平台具有通用性,通过合理设计能够按照一定比例负载多种药物从而达到多靶点治疗的目的。此外,作者强调了针对AD疾病进展阶段性变化的脑内微环境进行合理化设计,有利于其向精准医学的领域发展。最后,作者发现的交联诱导FRET效应有望成为AD早期脑内炎症诊断的有利工具。
原文链接:
https://doi.org/10.1002/adma.202408729
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#阿尔茨海默病# #多肽药物偶联物#
66
临床新进展,学习了(^.^)
56