指南更新 | 乳腺癌NCCN(2024.V6):新增inavolisib联合哌柏西利和氟维司群治疗晚期PIK3CA激活突变乳腺癌
2024-11-13 e路新干线 e路新干线
乳腺癌NCCN指南更新至2024.V6,此次药物治疗更新的主要内容为新增inavolisib+哌柏西利+氟维司群一线治疗晚期PIK3CA激活突变、HR阳性/HER2阴性乳腺癌推荐。

2024.V6-2024.11.11
乳腺癌
NCCN指南
2024年11月11日,乳腺癌NCCN指南更新至2024.V6,此次药物治疗更新的主要内容为新增inavolisib+哌柏西利+氟维司群一线治疗晚期PIK3CA激活突变、HR阳性/HER2阴性乳腺癌推荐。详细更新内容如下:
01 更新内容
ER和/或PR阳性复发性不可切除(局部或区域)或Ⅳ期(M1)疾病的全身治疗
HER2阴性和绝经后或接受卵巢切除或抑制的绝经前
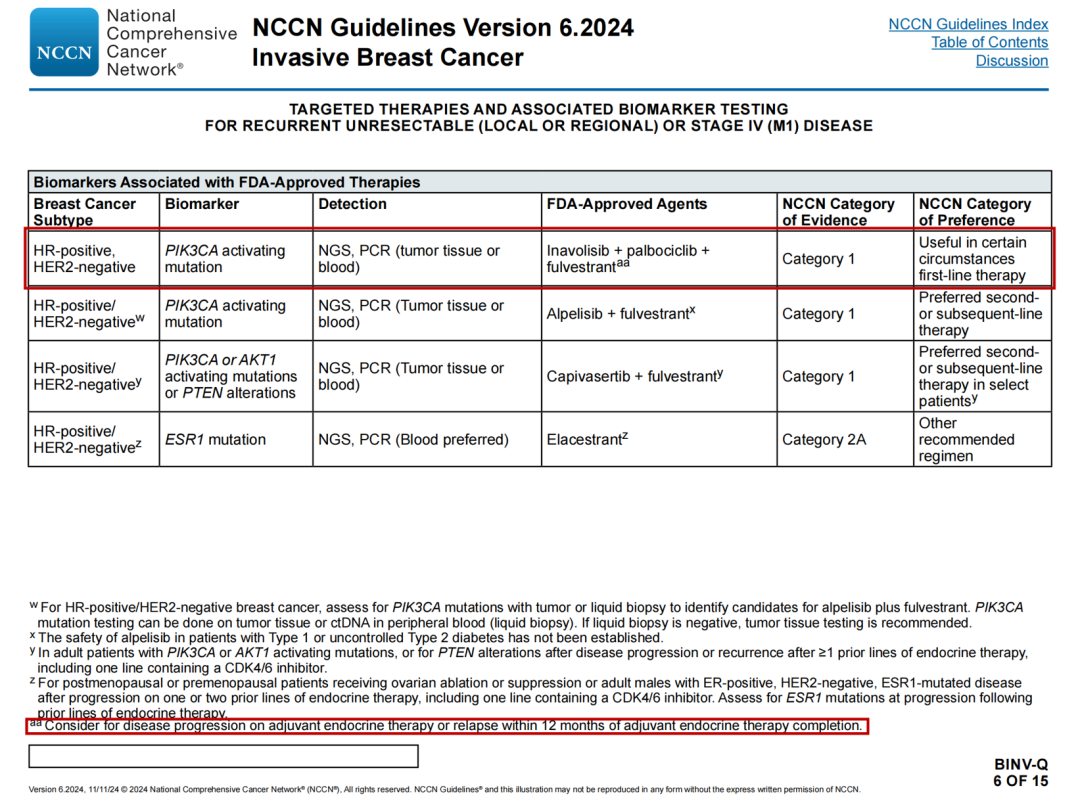
🔹首选方案,二线和后续治疗选项修改:对于PIK3CA或AKT1激活突变或PTEN变异的HER2阴性肿瘤,见靶向治疗选择,见BINV-Q(6)
🔹其他推荐方案,一线和/或后续治疗,选择性ER下调剂选项修改:对于HER2阴性疾病和ESR1突变肿瘤,见BINV-Q(6)
🔹某些情况下有用,新增:一线治疗:对于PIK3CA激活突变的HER2阴性肿瘤,辅助内分泌治疗期间疾病进展或辅助内分泌治疗完成后12个月内复发见靶向治疗选择,见BINV-Q(6)

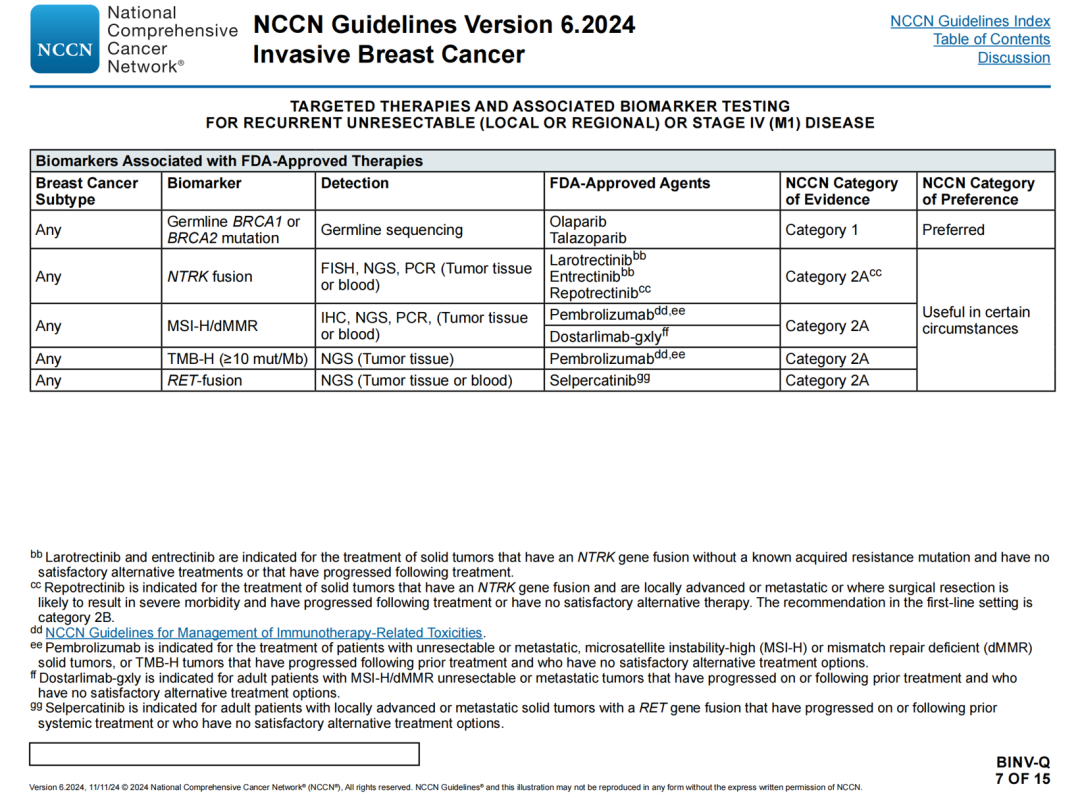
复发性不可切除(局部或区域)或Ⅳ期(M1)疾病的靶向治疗和相关生物标志物检测
FDA批准治疗相关的生物标志物
🔹新增inavolisib+哌柏西利+氟维司群行
🔹新增脚注aa:考虑用于辅助内分泌治疗期间疾病进展或辅助内分泌治疗完成后12个月内复发
🔹本页和BINV-Q 7/15检测列修订
剂量:复发性不可切除(局部或区域)或Ⅳ期(M1)疾病的靶向治疗和相关生物标志物检测
🔹新增inavolisib+哌柏西利+氟维司群方案:
-
inavolisib 9 mg PO QD D1-28
-
哌柏西利 125 mg PO QD D1-21
-
氟维司群 500 mg IM D1、15
28天为一周期,共1周期
-
随后
-
inavolisib 9 mg PO QD D1-28
-
哌柏西利 125 mg PO QD D1-21
-
氟维司群 500 mg IM D1
28天为一周期,直至疾病进展或毒性不可耐受

02 新增依据
inavolisib+哌柏西利+氟维司群方案的新增基于一项全球、多中心、双盲、随机对照的Ⅲ期临床研究(INAVO120研究;NCT04191499),该研究旨在评估一线inavolisib+哌柏西利+氟维司群 vs. 安慰剂+哌柏西利+氟维司群用于辅助内分泌治疗期间或完成治疗12个月内复发的PIK3CA突变、HR阳性/HER2阴性局部晚期或转移性乳腺癌的疗效和安全性。
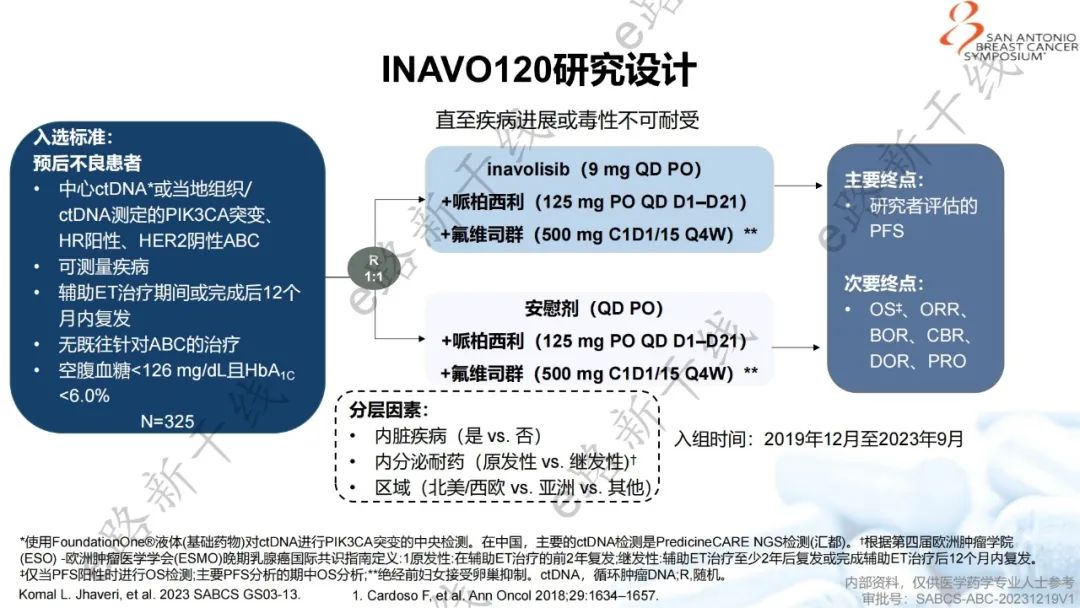
研究设计
2023年圣安东尼奥乳腺癌研讨会(SABCS)报告了该研究主要结果1,研究结果显示,中位随访时间21.3个月,INAVO120研究达到了主要终点,与安慰剂组相比,inavolisib组PFS有统计学显著和有临床意义的改善(15.0个月 vs. 7.3个月;HR=0.43,95% CI 0.32-0.59;p<0.0001),并且在关键亚组中观察到与总人群一致的获益。
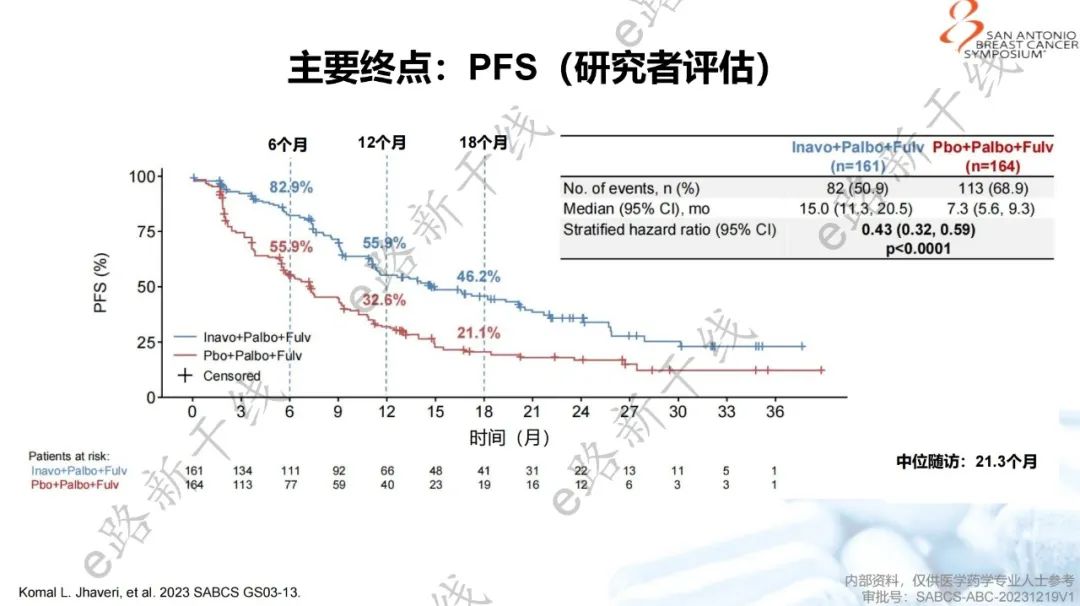
总人群PFS(研究者评估)
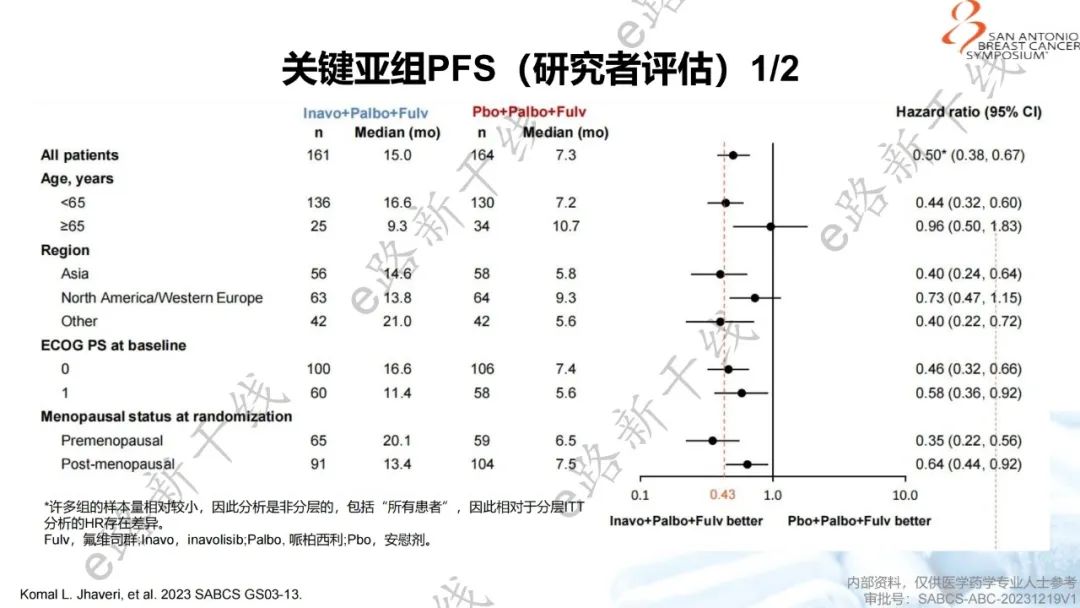
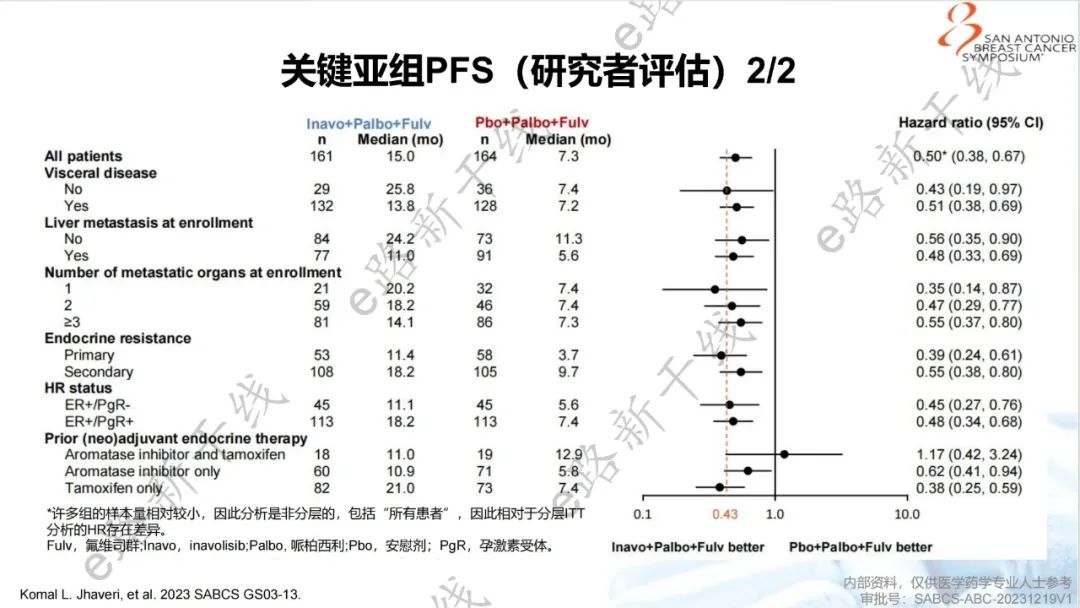
关键亚组PFS(研究者评估)
安全性方面,inavolisib组和安慰剂组3级或4级中性粒细胞减少症发生率分别为80.2%和78.4%;3级或4级高血糖发生率分别为5.6%和0%;3级或4级口腔炎或黏膜炎发生率分别为5.6%和0%;3级或4级腹泻发生率分别为3.7%和0%;未观察到3级或4级皮疹。因不良事件而导致任何药物停药的发生率在inavolisib组中为6.8%,在安慰剂组中为0.6%。inavolisib组安全性特征和既往研究一致,无新的安全信号。
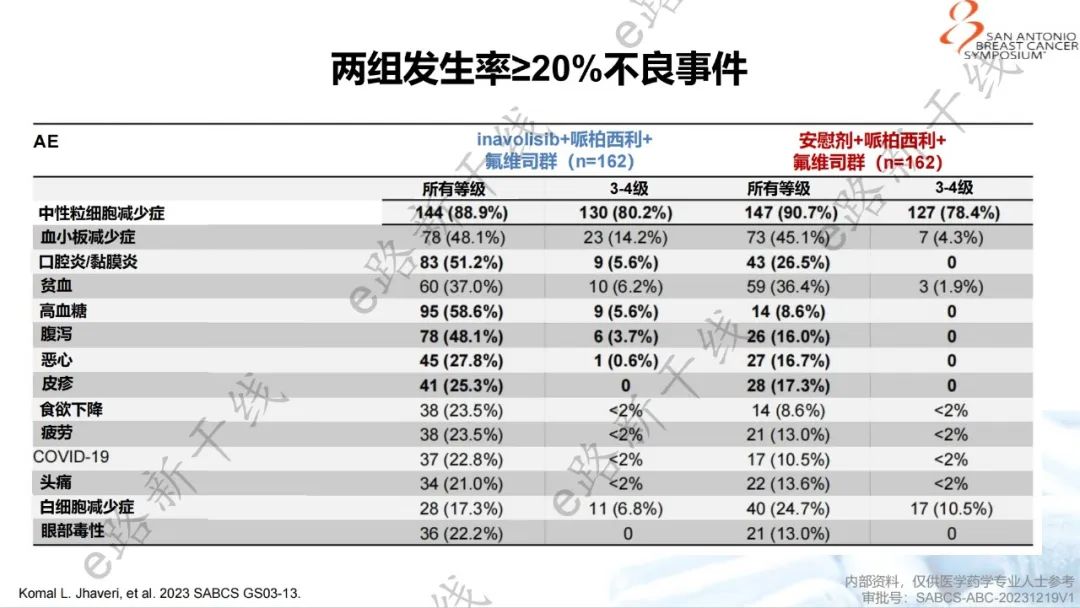
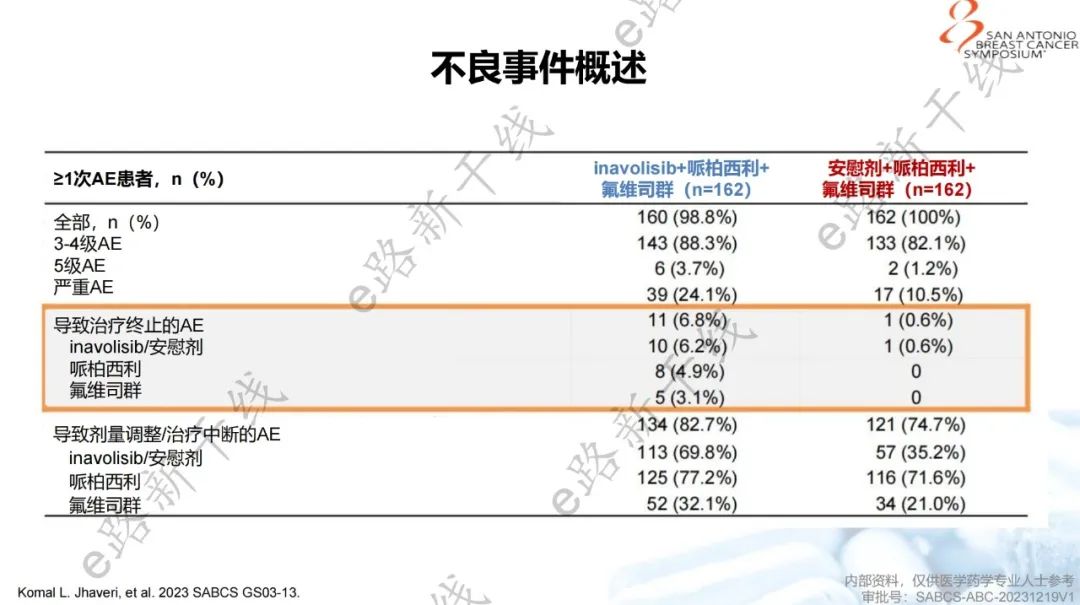
安全性结果
以上结果于2024年10月刊登于《新英格兰医学杂志》2。
2024年美国临床肿瘤学会(ASCO)年会报告了INAVO120研究的额外分析结果3,临床相关疗效终点包括自随机分组至下一线治疗结束或终止或全因死亡的时间(PFS2替代指标)和自随机分组至治疗停止后第一次后续化疗的时间(TTFC)。研究结果显示,中位随访时间21.3个月,inavolisib组的中位PFS2替代指标达到24.0个月,相比安慰剂组延长了8.9个月(24.0个月 vs. 15.1个月;HR=0.54,95% CI 0.38-0.77),中位TTFC尚未达到(NE vs. 15.0个月;HR=0.54,95% CI 0.37-0.78)。
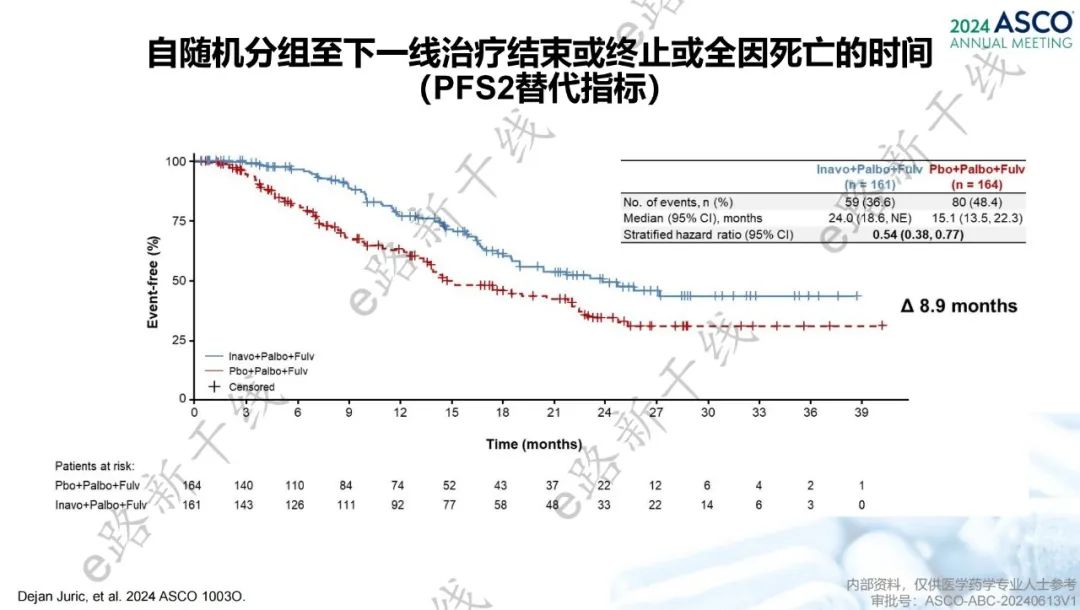
PFS2替代指标结果
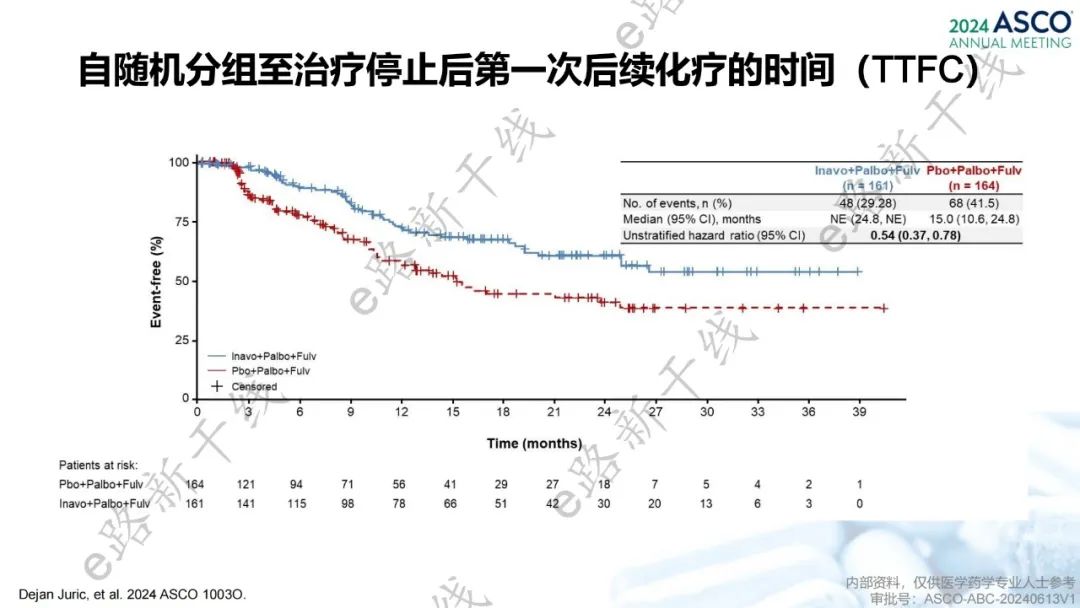
TTFC结果
2024年10月10日,基于INAVO120研究的积极结果,FDA批准了inavolisib联合哌柏西利和氟维司群用于治疗内分泌耐药、PIK3CA 突变、HR阳性/HER2阴性、局部晚期或转移性乳腺癌成人患者,这些患者经FDA批准的检测方法检测,并且在辅助内分泌治疗期间或完成后复发。
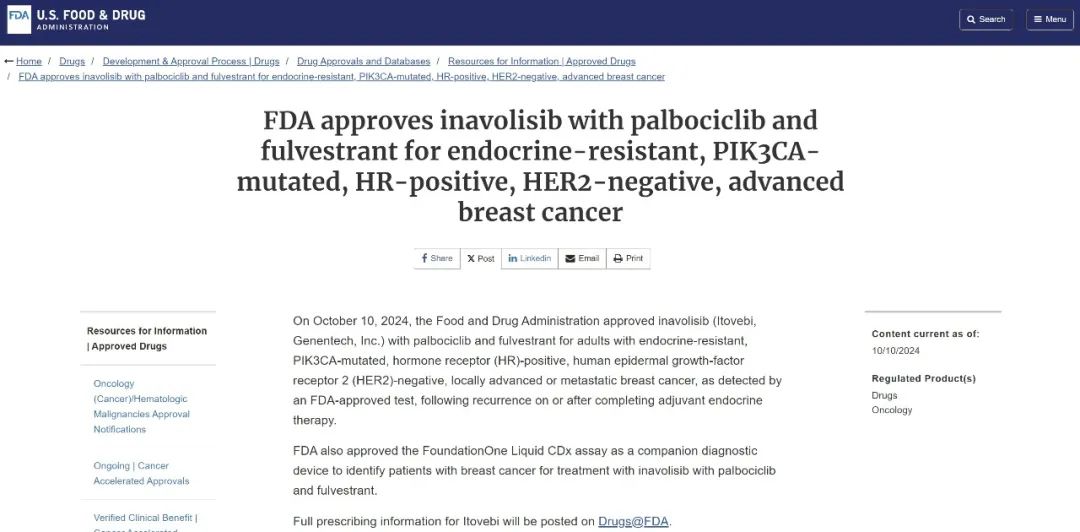
FDA关于inavolisib联合哌柏西利和氟维司群方案获批的公告
03 总结
HR阳性乳腺癌是最常见的乳腺癌类型,大约40%晚期HR阳性乳腺癌患者存在PIK3CA突变,该突变可导致PAM信号通路的异常激活,刺激肿瘤增殖、转移和侵袭,并与乳腺癌治疗耐药密切相关,因此,PIK3CA突变成为乳腺癌精准治疗的热门靶点。在INAVO120研究中,PI3Kα选择性抑制剂inavolisib和CDK4/6抑制剂哌柏西利的“靶向+靶向”联合内分泌治疗模式在内分泌经治的PIK3CA突变、HR阳性/HER2阴性局部晚期或转移性乳腺癌患者中显示出优越的疗效,增加了该类患者的治疗选择,进一步推动了当今精准医疗的发展。
参考文献:
1.Jhaveri KL, et al. 2023 SABCS GS03-13.
2.Turner NC, et al. N Engl J Med 2024;391:1584-1596.
3.Juric D, et al. 2024 ASCO 1003O.
4. NCCN指南:乳腺癌(2024.V6).
作者:e路新干线
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#乳腺癌##inavolisib#这么多的速度,世界都是内卷的
4
#乳腺癌# #inavolisib#
6