Nature Genetics:肥胖与致癌基因突变的复杂关联:对癌症预防和治疗的新启示
22小时前 生物探索 生物探索
本研究发现肥胖与某些癌症特定驱动基因突变有关,如肺腺癌中 KRAS 突变增加、EGFR 突变减少等,提出免疫、代谢等机制,具临床意义,也有局限性,未来需进一步研究。
引言
近年来,随着全球肥胖率的持续上升,肥胖(obesity)与癌症之间的关系引起了广泛关注。肥胖不仅显著增加心血管疾病和糖尿病等慢性病的风险,还与癌症的发生和进展密切相关。大量研究已证实,肥胖不仅增加了多种癌症的发生风险(如乳腺癌、肝癌和结直肠癌),还可能在癌症基因型的选择过程中发挥重要作用。这些癌症的高发不仅对患者的健康构成威胁,也给全球公共卫生系统带来了巨大的负担。10月28日Nature Genetics的报道“Obesity-dependent selection of driver mutations in cancer”,揭示了体质指数(BMI, Body Mass Index)与某些癌症中特定驱动基因突变之间的显著关联,并深入探讨这些发现背后的机制及其临床意义。

肥胖是全球范围内日益严峻的公共健康问题,其与多种癌症的发生有显著关联,例如肝癌和结直肠癌。然而,肥胖是否与特定癌症基因型的选择相关尚不明确。癌症的发生是一个极为复杂的过程,涉及生理、免疫、代谢等多方面的变化,而肥胖则能够显著改变机体的免疫监视、代谢及炎症状态,从而可能影响肿瘤细胞内部的基因突变选择压力,使某些驱动突变(driver mutations)在特定的肿瘤中更为常见。为了验证这一假设,研究人员利用纪念斯隆凯特琳癌症中心(Memorial Sloan Kettering Cancer Center, MSKCC)及其他机构的两个临床基因组数据集,系统性地分析了肥胖与多种癌症基因型之间的关系。
研究人员使用了MSK-IMPACT基因测序平台的数据,该平台通过杂交捕获技术对341个癌症相关基因进行了全面的基因组测序。研究对象包括34,274名患者,其中肺腺癌患者4,150名,子宫内膜癌患者433名,不明原发性癌症患者113名。所有患者的BMI数据在肿瘤样本采集时一并收集。研究人员通过统计建模分析BMI与肿瘤基因型之间的关联,重点分析特定基因在不同癌症类型中的突变频率,并控制了其他可能影响结果的因素,如年龄、性别、遗传背景和突变负荷(tumor mutational burden, TMB)。
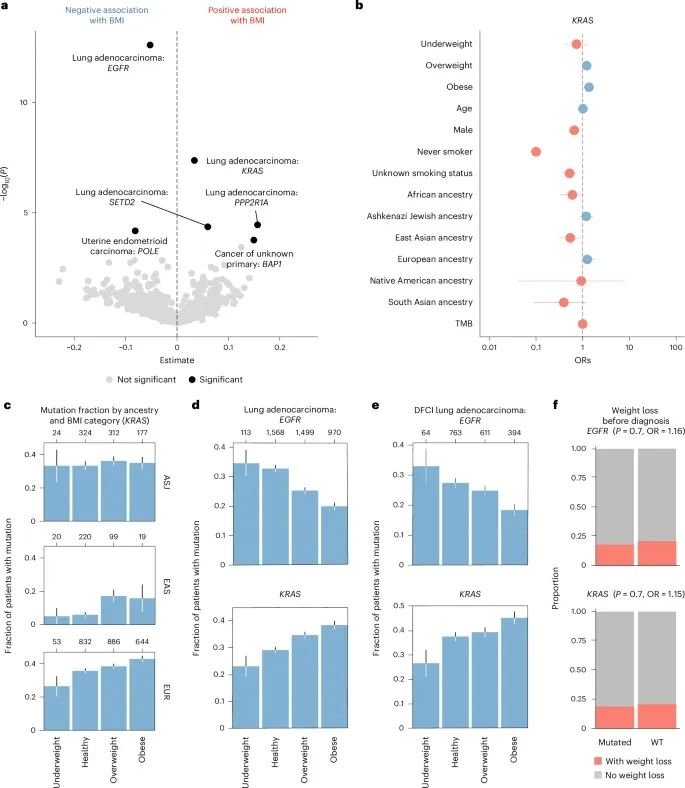
在数据分析中,研究发现肺腺癌患者中携带KRAS基因突变的数量为519人,其中肥胖患者(BMI≥30 kg/m²)KRAS突变的相对风险为1.52;而EGFR基因的突变患者数量为193人,相对风险为0.51。此外,在子宫内膜癌中,携带POLE基因突变的患者数量为20人,相对风险为0.41;在不明原发性癌症中,携带BAP1基因突变的患者数量为6人,相对风险为5.19。
为了确保结果的稳健性,研究人员在模型中纳入了多种临床变量,包括患者的年龄、性别、遗传背景及吸烟史,使用多变量回归模型来评估BMI与特定基因突变之间的独立关联。此外,还利用了来自不同机构的独立患者队列进行验证,以进一步确认研究结论的可靠性。
此外,研究人员还评估了其他可能的混杂因素,例如肿瘤分期、患者的生活方式因素(如饮食习惯和运动水平)以及药物使用情况等,以确保结果的准确性和全面性。通过对不同癌症类型和基因突变的广泛分析,研究人员得以揭示肥胖在癌症发展中的多维度影响。
研究结果显示,肥胖与某些癌症中特定驱动基因突变的频率存在显著关联。例如,在肺腺癌中,肥胖患者中KRAS基因的突变频率显著增加(q = 2.6 × 10⁻⁵),而EGFR基因的突变频率显著降低(q = 3.0 × 10⁻¹⁰)。具体来说,在4,150名肺腺癌患者中,519人携带KRAS突变,肥胖患者的KRAS突变相对风险为1.52,而EGFR突变患者数量为193人,相对风险为0.51。此外,SETD2基因和PPP2R1A基因在肥胖患者中的突变频率也有所增加,分别为0.06和0.16。
在子宫内膜癌患者中,POLE基因突变在低BMI患者中更为常见,其统计显著性为q = 1.6 × 10⁻²。在433名子宫内膜癌患者中,20人携带POLE突变,低BMI组的突变频率较高,相对风险为0.41。而在不明原发性癌症中,BAP1基因的突变与高BMI显著相关(q = 3.5 × 10⁻²),在113名不明原发性癌症患者中,有6人携带BAP1突变,相对风险为5.19。
研究还发现,肥胖与某些癌症类型中的其他驱动基因之间也存在关联。例如,在乳腺癌中,肥胖患者中PIK3CA突变的频率显著增加,而TP53突变频率相对较低。此类关联提示,肥胖在不同类型癌症中的作用可能通过多种机制实现,这不仅包括基因层面的变化,还涉及到肿瘤微环境和宿主免疫系统的复杂相互作用。
这些结果表明,肥胖不仅是癌症的一个重要风险因素,还是驱动特定基因突变选择的关键因素。通过多变量回归分析,即使在控制了患者的年龄、性别、遗传背景和吸烟史等因素后,肥胖与这些基因突变之间的关联依然显著。此外,研究还控制了可能的混杂因素,如遗传背景、吸烟量(以“包年”计算)以及肿瘤突变负荷,结果显示这些关联仍然具有统计学意义。
肥胖如何影响癌症的基因型选择是一个复杂的问题,研究人员提出了几种可能的机制。首先,肥胖会显著改变全身的免疫环境。研究发现,肥胖患者的CD8+ T细胞功能受到抑制,这可能导致免疫监视减弱,使得某些具有免疫原性的驱动突变更容易被保留下来。在肺腺癌中,这一现象在KRAS基因突变中尤为明显,肥胖患者中KRAS突变频率较高,而EGFR突变则较少发生,这可能与KRAS突变的肿瘤对免疫检查点抑制剂(immune checkpoint inhibitors)更为敏感有关。
其次,肥胖会显著影响癌细胞的代谢途径,尤其是脂质代谢。肥胖通过PIK3CA/雷帕霉素靶蛋白(mTOR)信号通路重新编程脂肪酸代谢,这些代谢变化可能促进携带特定驱动突变的癌细胞增殖。例如,在肥胖患者中,SETD2和PPP2R1A基因的突变频率增加,可能与脂质代谢的改变相关。此外,肥胖引发的慢性炎症也可能改变肿瘤微环境,增强促癌信号的传播,从而进一步增加某些驱动基因突变的选择压力。
肥胖还通过多种信号通路,如胰岛素样生长因子1(IGF-1)和肿瘤坏死因子α(TNF-α)等,影响癌细胞的生长和增殖。肥胖患者的胰岛素抵抗和慢性高胰岛素血症可能激活IGF-1信号通路,这一通路与细胞增殖和生存密切相关。高水平的TNF-α也可能促进炎症反应并改变肿瘤微环境,进而对癌细胞的选择压力产生重要影响。
研究还表明,肥胖患者的全身炎症水平升高可能通过多个途径影响癌症基因型的选择。例如,空气污染已被证明可以通过诱导微环境变化促进EGFR突变细胞的增殖,而肥胖引发的类似炎症反应也可能对癌症基因型的选择产生类似影响。通过对多重控制变量(如遗传背景、吸烟量等)的分析,研究人员发现,即使在控制这些因素后,肥胖对癌症基因型选择的影响依然显著。这些发现表明,肥胖可能通过免疫和代谢的双重机制驱动特定基因突变的发生及癌症的异质性演化。
肥胖不仅与某些癌症类型的发生相关,还可能通过选择特定基因突变影响癌症的基因型选择,从而对癌症的进展和治疗产生影响(Credit: Nature Genetics)
BMI与基因型之间的统计关联:连续体质指数(BMI)与基因-癌症类型对之间的统计关联。结果显示,BMI与某些癌症中特定致癌基因突变的频率之间存在显著的关联。
多变量回归分析:通过多变量回归,研究发现BMI的不同分类(体重过轻、健康体重、超重、肥胖)与KRAS基因突变存在独立于其他临床因素的关联。图中显示了BMI分类下KRAS突变的频率与其置信区间(95%)。
KRAS突变频率与BMI分类:在肺腺癌患者中,KRAS突变的频率根据BMI和遗传血统进行分类,结果显示在不同人群中的差异(如Ashkenazi犹太人、东亚人、欧洲人)。
EGFR和KRAS突变频率:在MSKCC和DFCI两个队列中,分别展示了EGFR和KRAS基因突变在不同BMI分类下的频率,肥胖患者中的KRAS突变频率显著高于其他BMI类别,而EGFR的突变频率则较低。
体重变化的影响:研究还探讨了癌症诊断前的体重变化对突变的影响,发现EGFR和KRAS突变与癌症诊断前的体重减轻无显著关联,这表明BMI与这些突变之间的关联不受诊断前体重变化的干扰。
该研究结果具有重要的临床意义。首先,KRAS和EGFR基因都有相应的靶向治疗药物,了解肥胖对这些基因突变频率的影响有助于个性化治疗的制定。例如,KRAS突变的肺腺癌患者对免疫治疗的反应较好,而在肥胖患者中,这类突变的频率更高,这提示肥胖患者可能更适合接受免疫检查点抑制剂治疗。
此外,在肥胖相关的癌症中,考虑到肥胖对特定基因突变的选择性影响,可能需要调整现有的治疗策略。例如,肥胖可能会改变药物代谢的速率,导致药物在肥胖患者体内的有效性和毒性不同。因此,针对肥胖患者的个体化治疗方案可能需要包括药物剂量的调整和对潜在副作用的监测。
其次,这项研究为肥胖在癌症发生和发展中的作用提供了新的视角。以往的研究大多关注肥胖增加某些癌症的总体风险,而该研究揭示了肥胖如何通过影响基因突变谱系来驱动癌症的异质性。这些发现提示,肥胖不仅影响癌症的发生风险,还影响癌症的基因演化过程,这对于制定更有效的癌症预防和治疗策略具有重要意义。
尽管该研究揭示了肥胖与癌症基因型选择之间的重要关联,但仍存在一些局限性。首先,研究主要集中在常见癌症类型和高频突变基因,对于罕见癌症类型和低频突变基因的分析能力有限。其次,BMI只是衡量肥胖的一个指标,未来的研究可以结合其他肥胖指标(如皮褶厚度、腰围等)以更全面地评估肥胖对癌症基因型的影响。此外,该研究主要基于回顾性数据,未来需要通过前瞻性研究来验证BMI的改变是否能够影响特定癌症基因型的发生率。
未来的研究还可以关注肥胖与其他癌症类型及其基因型之间的关系,并深入探讨肥胖通过免疫、代谢等途径影响癌症进展的具体分子机制。此外,通过临床干预降低BMI水平是否能够减少癌症发生及改变癌症的基因演化轨迹,仍需进一步的前瞻性临床试验加以验证。针对肥胖的预防和干预措施,如饮食和运动管理,可能成为降低特定癌症风险和改善癌症治疗效果的有效手段。
参考文献
Tang C, Castillon VJ, Waters M, et al. Obesity-dependent selection of driver mutations in cancer. Nat Genet. Published online October 28, 2024. doi:10.1038/s41588-024-01969-3
https://www.nature.com/articles/s41588-024-01969-3
作者:生物探索
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#肥胖# #癌症# #基因突变#
6