Nat Med:化疗难治性KRAS G12C结直肠癌应用索托雷塞+帕尼单抗,最新数据公布
2024-01-28 苏州绘真医学 苏州绘真医学
CodeBreaK 101主方案的1b期子研究在化疗难治性KRAS G12C突变转移性结直肠癌患者中评估了索托雷塞联合帕尼单抗治疗的疗效。本文报告了剂量探索队列和剂量扩展队列的结果。

RAS突变型转移性结直肠癌目前的三线(及以上)治疗方案疗效有限。研究开始时,研究者推测索托雷塞(索托拉西布,sotorasib,KRAS G12C抑制剂)和帕尼单抗(panitumumab,EGFR抑制剂)联合治疗可克服治疗引起的耐药。CodeBreaK 101主方案的1b期子研究在化疗难治性KRAS G12C突变转移性结直肠癌患者中评估了索托雷塞联合帕尼单抗治疗的疗效。本文报告了剂量探索队列和剂量扩展队列的结果。
患者接受了索托雷塞(960mg,每日1次)+帕尼单抗(6mg kg-1,每2周1次)治疗。主要终点为安全性和耐受性。次要终点包括疗效和药代动力学。研究者评估了基线时的探索性生物标志物。48例患者接受了治疗(剂量探索队列,n=8;剂量扩展队列,n=40)。任何级别和≥3级的治疗相关不良事件分别发生于45例(94%)和13例(27%)患者。在剂量扩展队列中,经证实的客观缓解率为30.0%(95%置信区间(CI) 16.6%-46.5%)。中位无进展生存期为5.7个月(95%CI 4.2-7.7个月)。中位总生存期为15.2个月(95%CI 12.5个月-无法估计)。常见的基因共变异包括APC(84%)、TP53(74%)、SMAD4(33%)、PIK3CA(33%)和EGFR(26%)。索托雷塞+帕尼单抗在化疗难治性KRAS G12C突变转移性结直肠癌中显示出可接受的安全性和有前景的疗效。ClinicalTrials.gov注册号:NCT04185883
研究背景
结直肠癌是第三大最常见的癌症类型,在美国每年有153,020例新发病例和52,550例死亡病例。有RAS突变的转移性结直肠癌的一线和二线治疗包括联合化疗、免疫治疗(对于微卫星高度不稳定的患者)和抗血管生成药物。这些患者的三线标准治疗是瑞戈非尼或曲氟尿苷替匹嘧啶,客观缓解率为2%,中位无进展生存期≤2个月,瑞戈非尼治疗的总生存期为6.4个月,曲氟尿苷替匹嘧啶治疗的为7.1个月。在最近一项曲氟尿苷替匹嘧啶联合贝伐珠单抗的研究中,中位无进展生存期和中位总生存期分别为5.6个月和10.8个月。这些结局强调了这类患者需要新的治疗方案和联合治疗方案。
KRAS G12C突变见于约3-4%的结直肠癌病例。关于KRAS G12C突变转移性结直肠癌治疗结局的真实世界研究报告了不同的结果。一些研究描述与预后呈负相关,而另一些报告无差异。索托雷塞可选择性地、不可逆地抑制KRAS G12C。在KRAS G12C突变的转移性结直肠癌患者中,索托雷塞单药治疗达到了中等客观缓解率(9.7%)。研究者推测,治疗诱导的耐药可能是通过RAS-MAPK通路的反馈再激活和EGFR信号的再激活导致的。
KRAS G12C抑制剂阿达格拉西布(adagrasib)和抗EGFR单克隆抗体西妥昔单抗(cetuximab)联合治疗KRAS G12C突变的转移性结直肠癌显示出临床活性和可接受的安全性。在CodeBreaK 101研究的这项1b期子研究(子方案H,第1部分队列A和第2部分队列A)中,研究者在化疗难治性KRAS G12C突变转移性结直肠癌患者中评估了索托雷塞+帕尼单抗治疗的安全性、药代动力学和疗效。研究者还报告了基线时共发生的基因变异及其与结局的关联。
研究方法
在KRAS G12C突变的成人晚期结直肠癌患者中对索托雷塞联合帕尼单抗开展的这项1b期、多中心、开放标签研究包括一个剂量探索队列和一个剂量扩展队列,计划的最大患者数量分别为15例和40例(图1)。剂量探索部分旨在评估索托雷塞联合帕尼单抗的安全性。根据之前报道的索托雷塞和帕尼单抗单药治疗研究,联合用药的推荐2期剂量为索托雷塞960mg(每日1次口服给药)和帕尼单抗6mg kg-1(每2周1次静脉给药)。由于预期未发生药物相互作用或显著的协同不良事件,因此研究者选择了一种剂量递减方案,从每种药物的推荐2期剂量开始,并计划在因毒性需要时降阶梯。剂量探索队列的患者开始接受每日960mg索托雷塞和每2周1次6mg kg-1帕尼单抗治疗,如果需要,将在后续研究中采用较小剂量(索托雷塞每日720或480mg,帕尼单抗每2周1次6或3mg kg-1)(图1)。
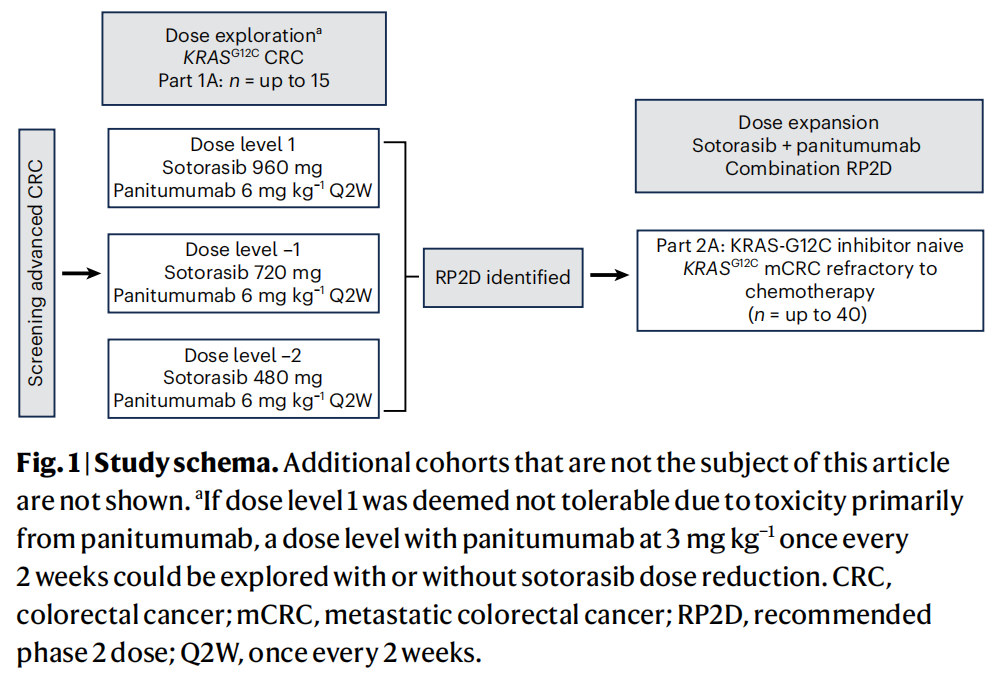
图1
剂量扩展队列接受了推荐的2期联合用药剂量,确定为索托雷塞960mg(每日1次口服)和帕尼单抗6mg kg-1(每2周1次静脉给药)。治疗持续至疾病进展、患者对研究药物不耐受、患者撤回知情同意或研究结束。
研究结果
研究人群:
本试验纳入了48例既往接受过至少1剂索托雷塞和帕尼单抗治疗的KRAS G12C突变转移性结直肠癌患者(在美国和日本纳入)(图1)。在2020年6月24日至2021年12月21日,8例患者被纳入剂量探索队列,40例患者被纳入剂量扩展队列(图2)。两个队列的数据截止日期均为2023年1月4日。
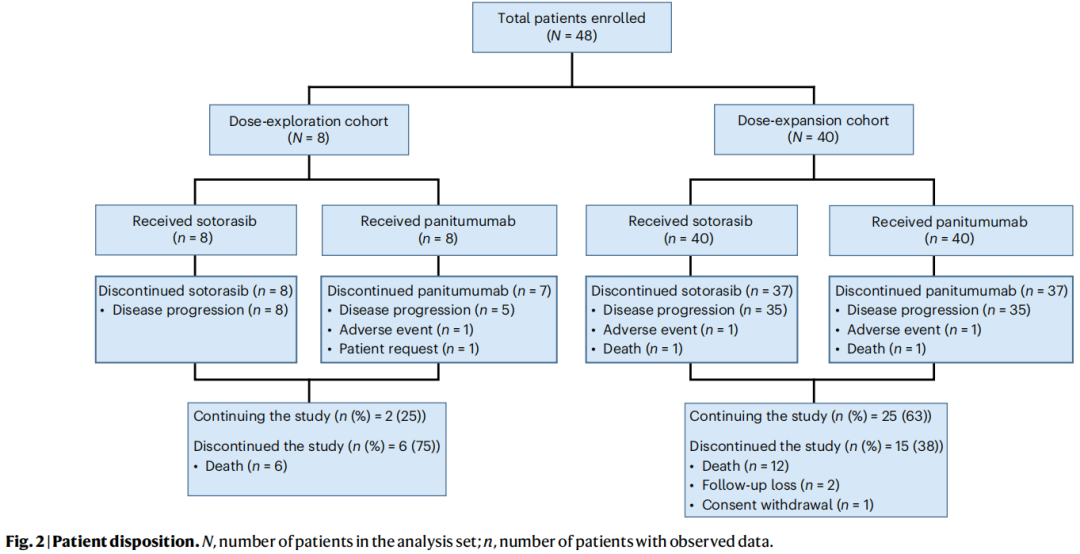
图2
表1总结了纳入剂量探索和剂量扩展队列的48例患者的基线特征。剂量探索队列(n=8)患者的中位年龄为61岁(范围31~79岁),63%为女性。患者既往因转移性疾病接受过的全身性治疗线数的中位数为4(包括如果在治疗后6个月内出现进展的辅助治疗)。既往接受过KRAS G12C抑制剂治疗的全部5例患者均接受过索托雷塞单药治疗或索托雷塞与曲美替尼联合治疗。
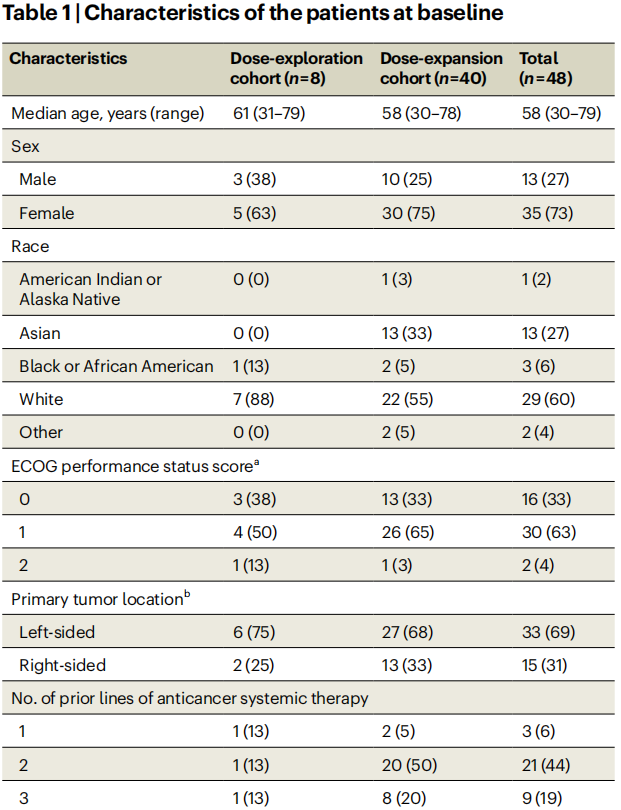
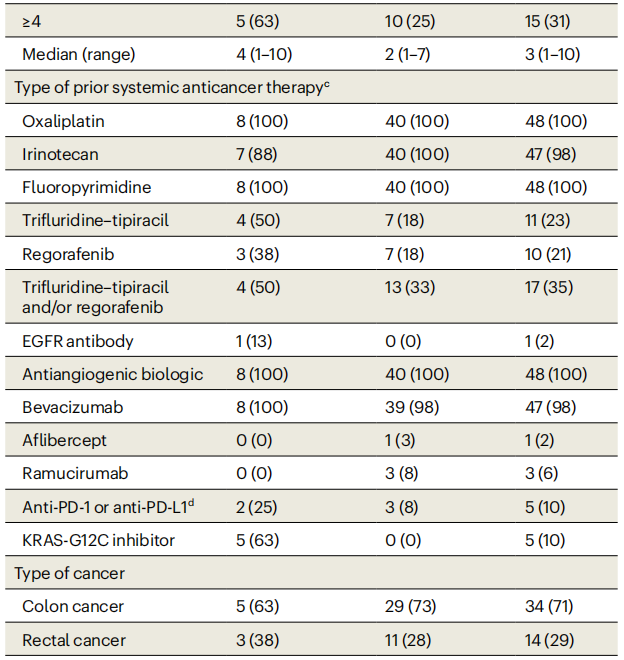
表1
在剂量扩展队列(n=40)中,中位年龄为58岁(范围30~78岁),75%为女性。原发肿瘤位于左侧27例(68%),右侧13例(33%)。患者既往因转移性疾病接受的全身性治疗线数中位数为2。40例(100%)患者既往接受过奥沙利铂、伊立替康、氟嘧啶和抗血管生成治疗。各有7例(18%)患者既往接受过瑞戈非尼和曲氟尿苷替匹嘧啶治疗,13例(33%)患者既往接受过瑞戈非尼和(或)曲氟尿苷替匹嘧啶治疗。
安全性:
在剂量探索队列中,有7例患者可评估剂量-限制性毒性(DLTs),未观察到DLTs(1例患者因非DLT(3级皮疹痤疮样)而中断帕尼单抗给药,因此无法评估)。因此,剂量水平1被确定为推荐的2期剂量。
在48例患者中,45例(94%)发生任何级别的治疗相关不良事件,13例(27%)发生≥3级治疗相关不良事件,分别有30例(63%)和45例(94%)患者发生了与索托雷塞和帕尼单抗相关的不良事件(表2)。13例(27%)患者发生了3级治疗相关不良事件,最常见的为皮疹(6%)、痤疮样皮炎(4%)和低镁血症(4%)。无患者发生4级或5级治疗相关不良事件。与索托雷塞相关的不良事件和与帕尼单抗相关的不良事件分别导致7例(15%)和14例(29%)患者中断给药或减量。两种药物均未发生导致停药的治疗相关不良事件。
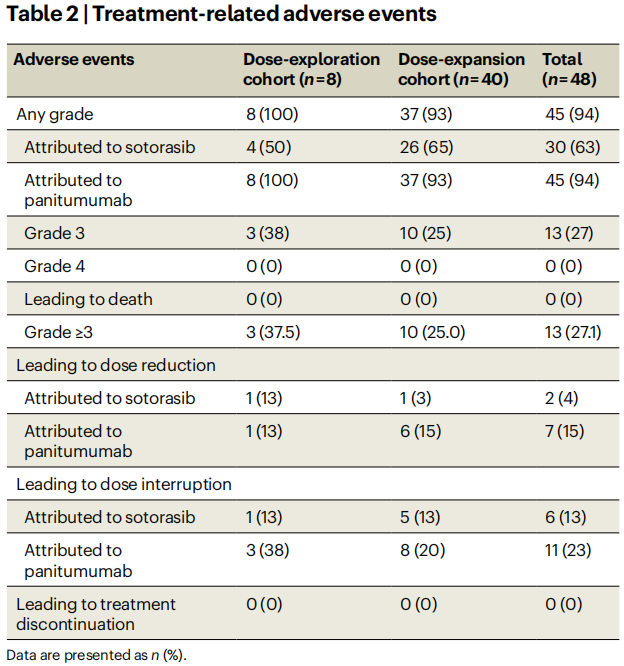
表2
药物代谢动力学:
对于整个人群,第1日和第8日的最大血浆浓度几何平均值分别为8760ng ml-1和7470ng ml-1,两日内至最大血浆浓度的中位时间均为1.0小时(范围为1.0~6.0小时)。第1日和第8日,给药后0~24小时的浓度-时间曲线下几何平均面积分别为80000h×ng ml-1和53500h×ng ml-1。
疗效:
在剂量探索队列的8例患者中,1例未接受过KRAS G12C抑制剂治疗的患者(12.5%;95%CI 0.3%-52.7%)有经证实的部分缓解(表3)。疾病控制率为75.0%(95%CI 34.9%-96.8%),中位治疗持续时间为4.4个月(范围1.4-21.8个月)。在数据截止时,没有患者仍在接受治疗。在既往接受过索托雷塞治疗的5例患者中,80.0%在治疗期间达到疾病稳定。在7例患者中观察到6例靶病变缩小(图3b)。由于临床进展,第8例患者在肿瘤评估前终止治疗。在既往接受过索托雷塞治疗的5例患者中,4例的靶病变最大肿瘤缩小范围为15%~30%,在未接受过KRAS G12C抑制剂治疗的2例患者中,最大肿瘤缩小为19%和100%。
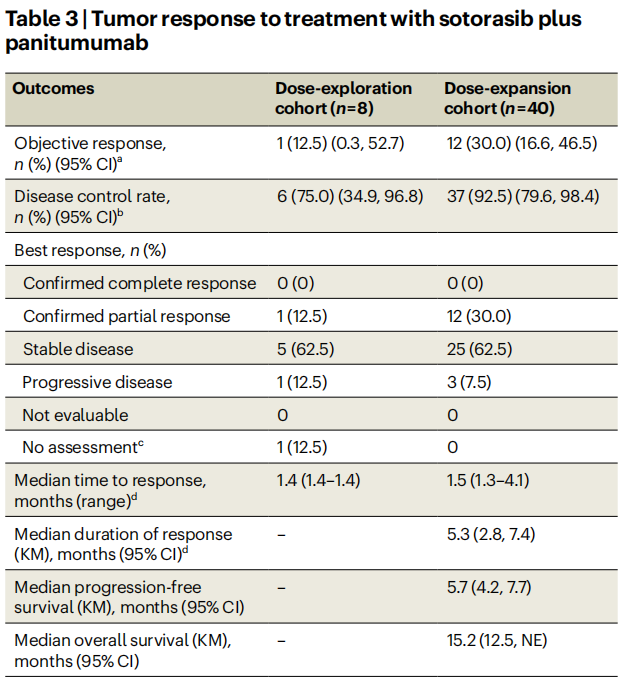
表3
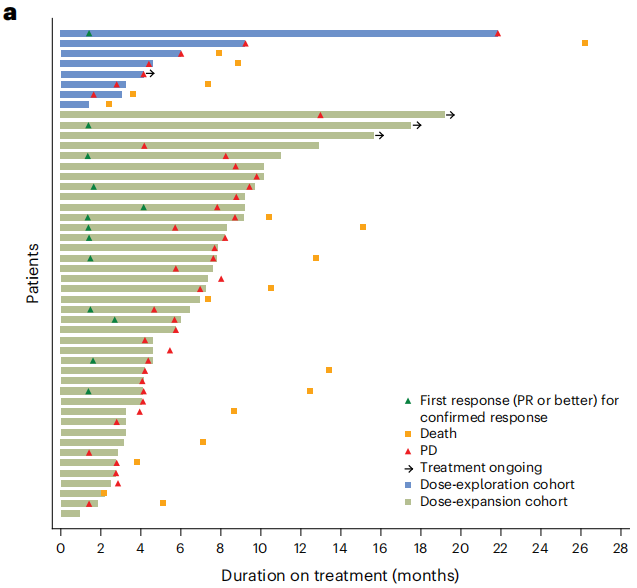
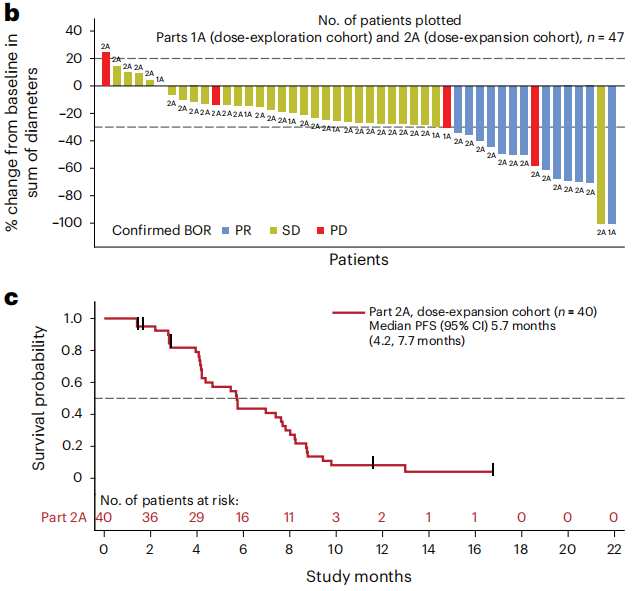
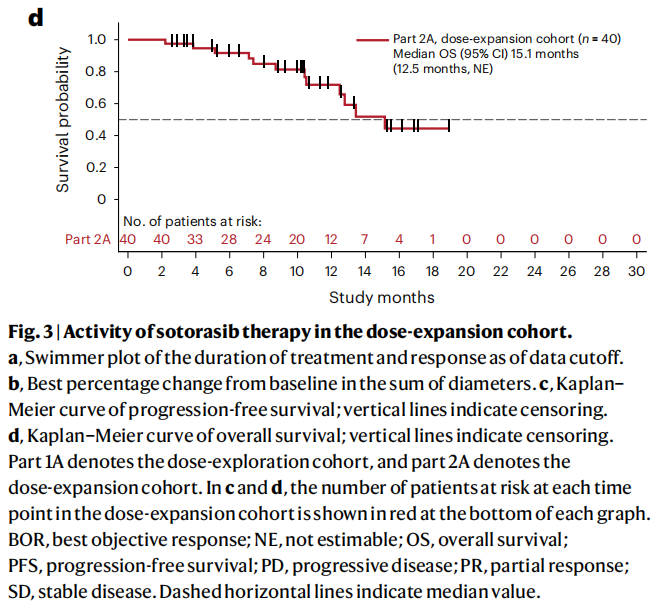
图3
在剂量扩展队列的40例患者中,12例(30.0%;95%CI 16.6%-46.5%)达到了经证实的部分缓解(表3和图3a)。疾病控制率为92.5%(95%CI 79.6%-98.4%),中位缓解持续时间为5.3个月(95%CI 2.8-7.4个月),40例患者中有35例观察到靶病变缩小(图3b)。中位缓解时间为1.5个月(范围1.3-4.1个月;表3)。中位治疗持续时间为6.0个月(范围0.5-18.9个月)。3例患者在数据截止时仍在接受治疗,联合治疗时间为15.6~19.2个月。中位随访16.7个月时,中位无进展生存期为5.7个月(95%CI 4.2-7.7个月;图3c)。中位随访10.6个月时,中位总生存期为15.2个月(95%CI 12.5个月-无法估计;图3 d)。
在亚组分析中,日本纳入的9例患者中有4例(44.4%)和美国纳入的31例患者中有8例(25.8%)观察到经证实的缓解。左侧(n=27)和右侧(n=13)患者的反应率分别为29.6%和30.8%。左侧和右侧原发肿瘤患者的中位无进展生存期分别为5.8个月和5.7个月。左侧和右侧原发肿瘤患者的中位总生存期分别不可估计和12.5个月。
基线时的探索性生物标志物:
在剂量探索队列和剂量扩展队列中,分别有3例(37.5%)和40例(100%)患者获得了集中检测的基线游离DNA(cfDNA)基因组数据。在剂量探索队列中,既往接受过KRAS G12C抑制剂治疗的患者(n=5)被排除出这项分析。所有患者在基线时均检测到cfDNA。41例患者检测到KRAS G12C突变,KRAS G12C变异丰度范围为0.0009~0.5810。最常见(≥20%)的基因变异包括APC(84%)、TP53(74%)、SMAD4(33%)、PIK3CA(28%)和EGFR (26%)。在同时有BRAF变异的患者(19%)中,6/8例(75%)患者为拷贝数扩增,3/8例(38%)患者为错义突变(1例患者同时有这两种变异)。所有患者均无BRAF V600E突变。在14%的单核苷酸变异患者中观察到ARID1A突变。11例患者同时发生的EGFR变异包括扩增(82%)和错义变异(18%)。在有和无基线BRAF变异的患者中中位无进展生存期分别为2.9个月(95%CI 2.4个月-不可估计)和7.4个月(95%CI 5.5-8.3个月),以及在有和无ARID1A突变的患者中分别为4.4个月(95%CI 2.8个月-不可估计)和7.4个月(95%CI 4.4-8.2个月)。
讨 论
在这项1b期临床试验中,研究者在既往接受过大量治疗的KRAS G12C突变转移性结直肠癌患者中评估了索托雷塞联合帕尼单抗治疗的安全性和疗效。联合治疗的耐受性良好,主要与低级别不良事件相关。总体而言,27%的患者发生了3级与治疗相关的不良事件(大多数为皮肤不良事件),分别有7例(15%)和11例(23%)患者发生了与索托雷塞和帕尼单抗相关的不良事件。未发生4级或5级与治疗相关的不良事件,也未发生导致停药的不良事件。所有患者均未出现DLTs。在索托雷塞单药治疗和联合治疗之间,未观察到明显的药代动力学差异,提示索托雷塞和帕尼单抗之间不存在有临床意义的药代动力学药物相互作用。CodeBreaK 300试验近期的3期数据进一步加强和证实了索托雷塞+帕尼单抗治疗的这些疗效和安全性结果,该试验表明,在化疗难治性KRAS G12C突变转移性结直肠癌患者中,与目前的标准治疗相比,索托雷塞+帕尼单抗治疗显著改善了无进展生存期。此外,CodeBreaK 300试验的索托雷塞每日960mg+帕尼单抗每2周1次6mg kg-1治疗组报告的客观缓解率为26.4%,中位无进展生存期为5.6个月,与本项1b期试验中报告的缓解率为30%,中位无进展生存期为5.7个月相似。
在剂量扩展队列中,经证实的客观缓解率是剂量探索队列的两倍以上,这可能反映出剂量探索队列中63%的患者之前接受过KRAS G12C抑制剂治疗。在剂量扩展队列中,93%的患者达到了疾病控制,88%的患者肿瘤缩小,中位无进展生存期为5.7个月,中位总生存期为15.2个月。这些结果与BRAF抑制剂与抗EGFR抗体联合治疗 BRAF V600E突变型转移性结直肠癌时观察到的结局相似,这意味着抑制过度活跃的RAS-BRAF-MAPK通路需要同时抑制EGFR 。这些数据表明,与帕尼单抗或索托雷塞单药治疗KRAS G12C突变转移性结直肠癌相比,联合治疗有显著改善。联合治疗比任何一种药物单独治疗更有效的这一发现与最近2期非随机KRYSTAL-1试验的结果基本一致,该试验检验了KRAS G12C抑制剂adagrasib与西妥昔单抗联合治疗KRAS G12C突变结直肠癌。索托雷塞+帕尼单抗治疗中最常见的治疗相关不良事件(皮疹、痤疮样皮炎、低镁血症)也与adagrasib-西妥昔单抗和抗EGFR治疗转移性结直肠癌时的总体不良事件一致。由于研究设计、既往治疗线数、患者人群、样本量(与本研究相比,KRYSTAL-1的患者相对较少)和纳入患者的地区(KRYSTAL-1仅在美国的研究中心纳入了患者,而本研究还纳入了来自日本的研究中心的患者;KRYSTAL-1仅在美国的研究中心纳入了患者,而本研究还纳入了来自日本的研究中心的患者),将当前数据与KRYSTAL-1数据进行直接比较具有挑战性。在这一预期对帕尼单抗无应答的KRAS G12C突变癌症患者人群中,结果证明了索托雷塞和抗EGFR抗体协同作用的原理,正如在临床前研究中观察到的那样。
研究观察到,无论原发肿瘤部位如何,索托雷塞+帕尼单抗联合治疗均显示出相似的疗效,这与BRAF和EGFR抑制剂联合治疗BRAF V600E转移性结直肠癌的数据一致。然而,由于本亚组分析的样本量小且存在重叠CIs,因此必须谨慎解读结果。未来对更大患者人群的研究可能会产生更明确的结果。
研究观察到BRAF或ARID1A共变异与较短的无进展生存期相关,这在机制上是合理的,并且与认为这些基因与EGFR抑制剂耐药相关的研究一致。虽然在EGFR抑制剂治疗后观察到BRAF扩增,但其与结局的关联尚不清楚。值得注意的是,有基线BRAF变异的患者均未接受过BRAF靶向治疗,只有1例患者接受过抗EGFR(西妥昔单抗)治疗。因此,这一变异似乎并不直接反映对之前联合靶向BRAF和EGFR治疗的获得性耐药。研究检测到的BRAF拷贝数变异的高发生率可能与研究者对血液样本和肿瘤组织的测序方法有关,因为血液样本测序可能更好地捕捉肿瘤间和肿瘤内的克隆异质性。使用血液测序的其他结直肠癌研究也观察到较高的BRAF拷贝数变异率。ARID1A功能缺失被认为会破坏SWI/SNF染色质重塑复合物的稳定,并促进肿瘤生长,其部分机制是通过调节EGFR下游效应蛋白。最近的一项3期研究强调了这一作用,该研究将ARID1A功能失调与西妥昔单抗(与贝伐珠单抗相比)治疗后的不良结局相关联。
本研究有一些局限性。首先,这是一项单臂研究。其次,疗效终点是基于研究者的评估,而不是基于盲法独立集中审核。最后,基因共变异的探索性分析无统计学效用。
在本研究的同时,3期CodeBreaK 300试验正在进行中,该试验在化疗难治性KRAS G12C突变转移性结直肠癌患者中比较两种剂量(960 mg和240 mg)索托雷塞+帕尼单抗与研究者选择的曲氟尿苷替匹嘧啶或瑞戈非尼,结果表明这两种剂量的联合治疗策略均延长了无进展生存期。此外,作为主要计划的一部分,正在进行的其他实体瘤研究正在评估索托雷塞与其他靶向或非靶向治疗(包括垂直和水平信号通路抑制剂,以及化疗)联用的安全性和疗效。
CodeBreaK 101主方案的这项1b期子研究表明,对于化疗难治性(在接受氟嘧啶、奥沙利铂、伊立替康和一种抗血管生成药物治疗期间或之后)KRAS G12C突变的转移性结直肠癌患者,索托雷塞联合帕尼单抗具有可接受的安全性和有前景的疗效。这项子研究还报告了在日本的一组患者亚群中,KRAS G12C抑制剂和抗EGFR抗体联合治疗的临床益处。基线BRAF非V600E或ARID1A共变异与较短的无进展生存期之间的潜在关联具有重要临床意义。未来的研究可能会评估这些探索性生物标志物的临床意义。总之,本研究数据为结直肠肿瘤中EGFR-MAPK通路的持续激活提供了更多的证据,并且可能对治疗其他RAS突变的结直肠癌具有更广泛的意义。
参考文献:
Kuboki, Yasutoshi et al. “Sotorasib with panitumumab in chemotherapy-refractory KRASG12C-mutated colorectal cancer: a phase 1b trial.” Nature medicine vol. 30,1 (2024): 265-270. doi:10.1038/s41591-023-02717-6

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









谢谢分享
26
#化疗# #结直肠癌# #帕尼单抗# #索托雷塞#
34