FDA批准Leqvio作为一种附加疗法,以帮助降低某些高危成人的胆固醇水平
2021-12-23 Allan MedSci原创
相比于安慰剂,Leqvio 提供了高达 52% 的“有效和持续的”低密度脂蛋白胆固醇降低,尽管所有患者均接受了最大耐受他汀类药物治疗。
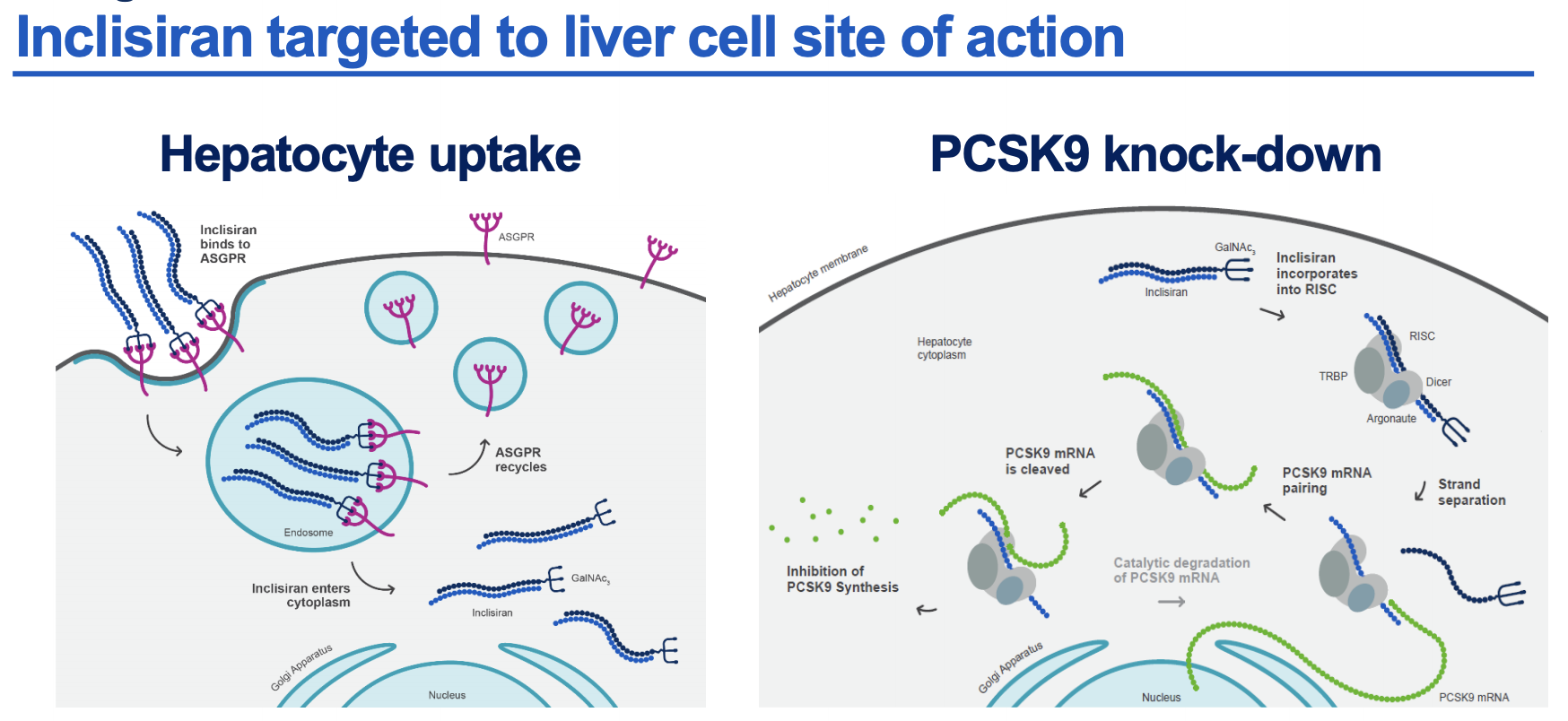
诺华周三表示,FDA 已批准其靶向 PCSK9 的 siRNA Leqvio(inclisiran)作为一种附加疗法,以帮助降低某些高危成人的胆固醇水平。该药物将于2022年 1 月初上市,适用于需要额外降低 LDL 胆固醇的杂合子家族性高胆固醇血症 (HeFH) 或临床动脉粥样硬化性心血管疾病 (ASCVD) 患者,但需要与他汀类药物联合使用。
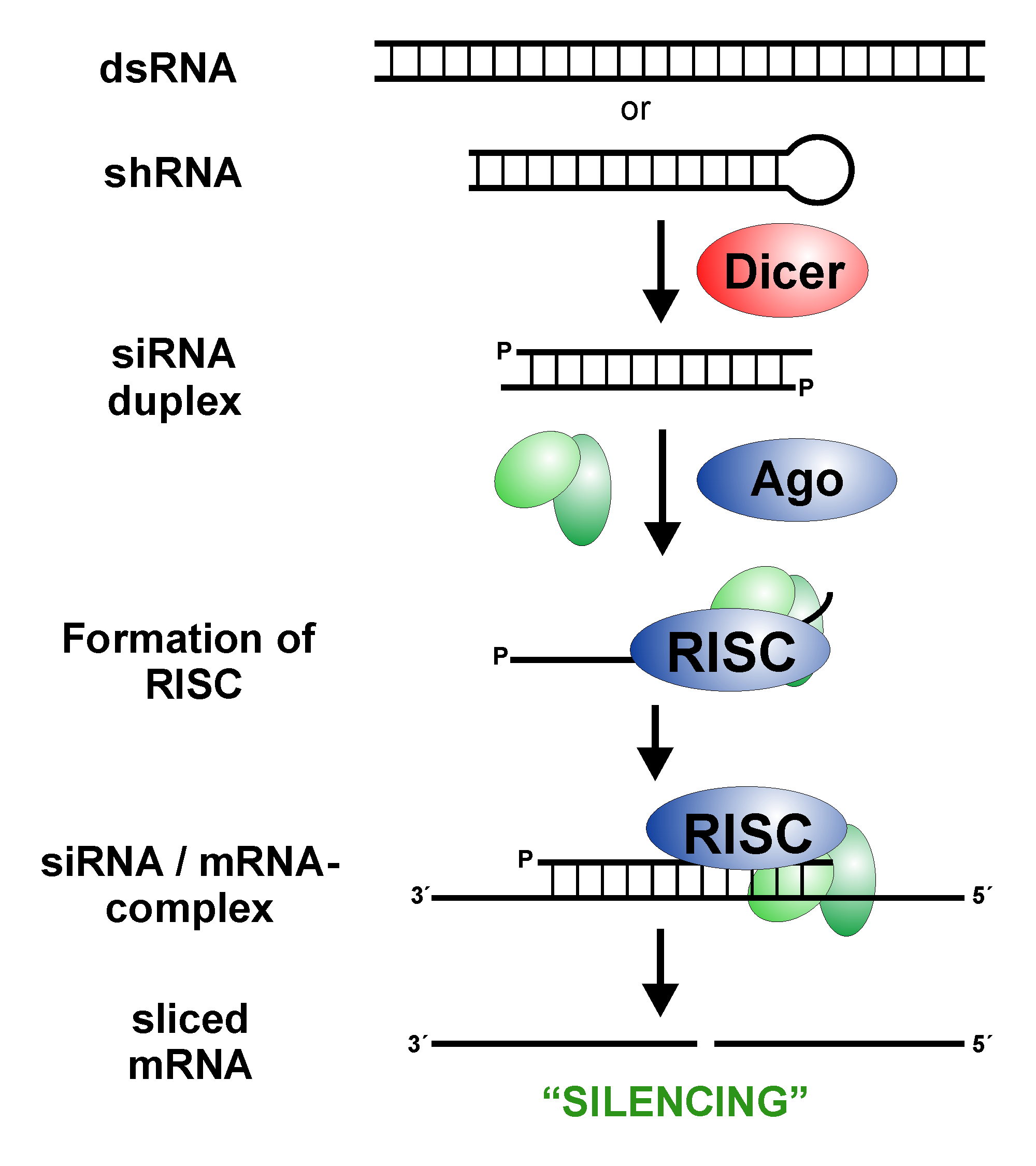
诺华首席执行官 Vas Narasimhan 评论道:“Leqvio 是一种革命性的疗法,它是有史以来第一个获批的用于降低低密度脂蛋白胆固醇的基于 siRNA 的疗法”。
继去年最初被拒绝之后:
大约一年前,美国食品和药物管理局发布了一封完整的回复函,拒绝了Leqvio的上市申请,理由是第三方生产设施存在“未解决的”问题。诺华公司在今年夏天重新提交了 Leqvio 的申请。该公司表示,在重新提交的申请中,它把自己在奥地利的工厂列为最终成品的制造地点。
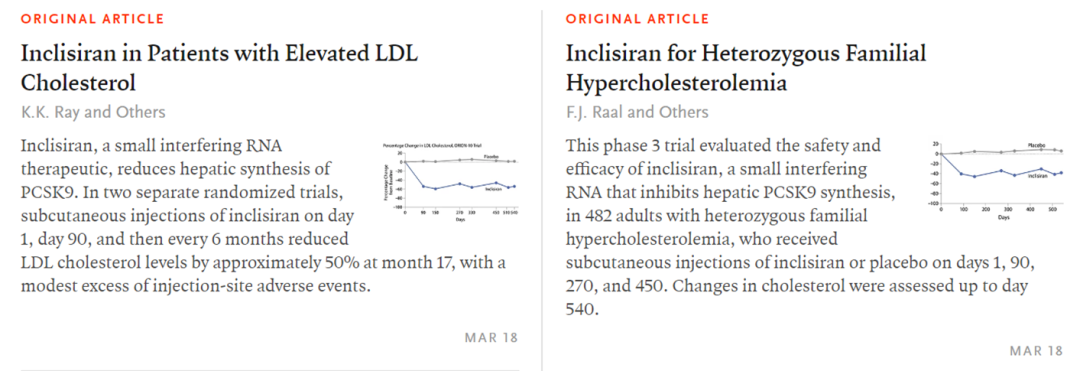
FDA 的决定是基于 ORION 临床开发计划的结果,包括 III 期 ORION-9、ORION-10 和 ORION-11 研究,相比于安慰剂,Leqvio 提供了高达 52% 的“有效和持续的”低密度脂蛋白胆固醇降低,尽管所有患者均接受了最大耐受他汀类药物治疗。该药物还具有与安慰剂相当的安全性,最常见的副作用是轻度至中度注射部位反应、关节疼痛、尿路感染、腹泻、胸冷、腿部或手臂疼痛以及呼吸急促。
Leqvio 通过皮下注射给药,三个月后进行第二次给药,此后每年继续治疗两次。欧洲药品管理局于去年 12 月对其进行了授权。同时,目前正在研究 Leqvio 对心血管结局的影响。
这家瑞士制药商于 2020 年 1 月以 97 亿美元收购 The Medicines Company的Leqvio。
原始出处:
作者:Allan
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#FDA批准#
63
应性皮炎(AD)是一种慢性炎症性瘙痒
75