【协和医学杂志】维特鲁威图:一种直观展示证据汇总结果的可视化工具
2024-07-15 协和医学杂志 协和医学杂志
本文结合具体案例,阐述和演示V plot在指南证据汇总中的应用,旨在优化多干预、多结局复杂证据的呈现,促进证据传递的准确性、全面性、易读性,为促进循证决策提供借鉴和参考。
循证决策是基于证据的价值判断和选择,是现代医学实践的核心。基于循证医学方法制订的临床实践指南(下文简称“指南”)被公认为高质量医疗卫生服务的可靠指导[1]。推荐意见是指南的精华和灵魂,是基于系统评价证据,在全面、综合权衡不同干预措施的潜在获益和风险后,形成的能够为医疗保健消费者提供最佳医疗服务的具体指导。推荐意见自形成至实施,伴随一系列循证决策过程,从证据至推荐是其中最为复杂和困难的环节[2]。
根据标准指南制订方法[3],指南制订者根据目标问题,组织由专业循证医学研究者构成的证据评价组全面收集和评价证据,并将结果归纳形成证据汇总信息,而后采用问卷等方式传递给由多种角色的利益相关者组成的共识专家组,在综合考虑证据、临床经验、患者偏好与价值观、卫生经济学等因素后,作出利弊平衡的价值判断和选择,形成推荐意见。
研究的深入和技术的进步正不断丰富医疗保健消费者的选择,加上以中西医结合为代表的整合医学快速发展,解决临床问题的可选方案数量激增[4]。然而,通常情况下很少有高确信度的证据能够帮助决策者从众多选项中明确区分出最佳干预措施,更多时候需要决策者从多方面、多角度、多层次对不同干预措施的潜在获益与风险进行综合而细致的权衡。
此外,疾病的复杂性和医疗保健消费者的偏好与价值观差异均会放大不同干预措施间由于利弊差异导致的决策困难。多种障碍因素的共同作用,对决策者全面把握决策信息和综合分析潜在利弊提出了严峻挑战[5]。
正确把握证据信息是作出高质量决策的前提。信息的呈现形式可能显著影响读者的理解和行为。使用GRADE(Grading of Recommendations Assessment,Development,and Evaluation)方法形成证据决策表[evidence to decision (EtD) table]是指南汇总决策信息的常用形式[6]。
对于专业的循证医学研究者而言,证据决策表能够准确、详细地传达干预措施在各个结局上的效应大小(相对效应估计值和绝对效应估计值)、效应的显著性和不确定性(95%可信区间)、证据的确信度(GRADE评估结果)等决策信息,从而帮助决策者理解和把握证据情况。
然而,参与指南推荐意见共识和决策的专家组成员通常包括多学科专家、临床医生、患者代表和其他利益相关者,其可能并不具备丰富的循证医学相关知识。考虑到分析判断过程的全面性和复杂性,任何信息在传递和理解上的障碍均可导致决策产生偏倚,甚至导致重要决策信息的遗漏[7];而结局与干预措施一一对应的呈现形式,可能不利于非专业决策者构建不同干预措施间的综合利弊比较。
相校于传统的文字或表格,精心设计的图形是帮助信息使用者更好地理解和把握信息的一种有效方法。尤其在传递复杂、综合信息方面,构建可视化方案可能是最佳策略[8]。De Crescenzo等[9]在Lancet 发表的网状Meta分析研究,使用了一种信息综合和视觉效果较强的证据呈现方法,并取名为维特鲁威图(vitruvian plot)。MERGE工作组[10]在其基础上进行改良和优化,制作了适用于循证决策过程中证据汇总的同名可视化工具(下文简称“V plot”)[11]。本文结合具体案例,阐述和演示V plot在指南证据汇总中的应用,旨在优化多干预、多结局复杂证据的呈现,促进证据传递的准确性、全面性、易读性,为促进循证决策提供借鉴和参考。
1 应用方法
应用V plot的目的是提升证据汇总信息传递的准确性和效率,在服务于决策的证据汇总中,V plot更具备应用潜力和价值。在指南制订过程中,从证据至推荐这一环节,研究者可根据证据决策表绘制V plot,以可视化呈现证据情况,从而在小组讨论、专家共识等环节发挥辅助决策作用。V plot的具体应用方法如下。
1.1 确定呈现信息
根据EtD框架[6],从证据至推荐需侧重考量的关键信息包括:使用干预措施的潜在获益与风险;相对于对照措施,该干预措施潜在获益与风险的效应显著性及大小;证据的不确定性;证据的确信度等。
绝对效应在呈现定量数据时更具直观性,有利于决策者准确理解证据信息,并联系自身经验和实际情况[12]。如证据显示,每周减少3份加工肉制品的摄入与更低的全因死亡率相关(RR=0.92,95% CI:0.87~0.96)[13]。尽管加工肉制品是极为常见的暴露因素,但人们很难根据证据提供的相对风险判断减少摄入所带来的实际获益,甚至可能无法理解这组定量数据的含义,并作出是否应减少加工肉制品摄入的决策。
而将相对效应转换为绝对效应后,该证据可被解读为:每周减少3份加工肉制品的摄入,能够在每1000人中减少9例全因死亡事件的发生,95%可信区间为最高减少15人,最低减少5人。此时,决策者可轻易将证据联系到自身经验和实际情况,并作出价值判断和选择,决定是否有必要为此类潜在获益而减少加工肉制品的摄入。因此,笔者建议优先使用绝对效应呈现干预措施效果。
最小重要性差值(MID)是指在无副作用和成本负担的情况下,应用干预措施导致具有临床意义的获益或风险的最小变化值。MID有助于进一步辅助决策[14]。如将全因死亡结局的MID设置为20例/1000人,每周减少3份加工肉制品的摄入带来的获益变化并未达到具有临床意义的最低要求,即使结果具有统计学差异,但微乎其微的获益可能并不足以促成饮食习惯的改变。
此外,GRADE工作组提出了背景化框架(contextualised framework),通过决策阈值将效应大小划分为多个层次[15-16]。设置3个阈值可将效应区分为微小至无(trivial to no effect)、较小(small benefit or harm)、中等(moderate benefit or harm)和较大(large benefit or harm)的有利或不利效应,以进一步细化干预措施实施效果的临床意义。
如证据显示,相对于对照措施,使用蒙脱石散治疗儿童急性腹泻能够缩短腹泻持续时间(MID=-23.90 h,95% CI:-30.80~-16.96)[17]。该证据虽可让决策者清晰地理解潜在获益为缩短近1 d 的腹泻持续时间,但不同价值尺度的决策者对该效果的判断可能不同,影响其作出推荐及确定推荐强度。在为腹泻持续时间设置决策阈值后,缩短0~3 h被认为效果微小或无效,缩短3~12 h可认为效果较小,缩短12~24 h可认为效果中等,缩短24 h以上可认为效果较好。此时,决策阈值可向不同价值尺度的决策者提示效应的临床意义[18-19]。因此,笔者建议应用MID和背景化框架辅助决策,以增强决策与临床实际的贴合程度。
GRADE方法是最常用的证据确信度评估工具之一,通过评价偏倚风险、间接性、不精确性、不一致性、发表偏倚5个降级因素和大效应、剂量反应关系、负偏倚3个升级因素,将证据确信度分为高、中、低、极低4个等级[20]。证据确信度能够直观反映对证据的总体把握程度,有效提示潜在的不确定性,是作出推荐意见和确定推荐强度的关键依据。例如,减少加工肉制品摄入降低全因死亡率的证据确信度被评价为低,提示决策者该结果可能与真实值差距很大。因此,笔者建议应用GRADE方法评估证据确信度,并在证据可视化汇总中呈现评估结果。
1.2 绘制图形
V plot是基于极坐标系构建的正圆形结构图形,将主体划分为多个板块从而综合呈现不同维度的定量数据和定性信息。其主要用途是汇总呈现一种干预措施在不同结局上的效果,从而辅助复杂、综合的价值判断和选择。V plot可通过R等软件绘制,相关代码可在原文获取[21]。
以莫诺拉韦(molnupiravir)治疗非重型COVID-19的证据汇总图为例,围绕圆心发散开的多个扇面分别对应不同的患者重要结局(图1)。
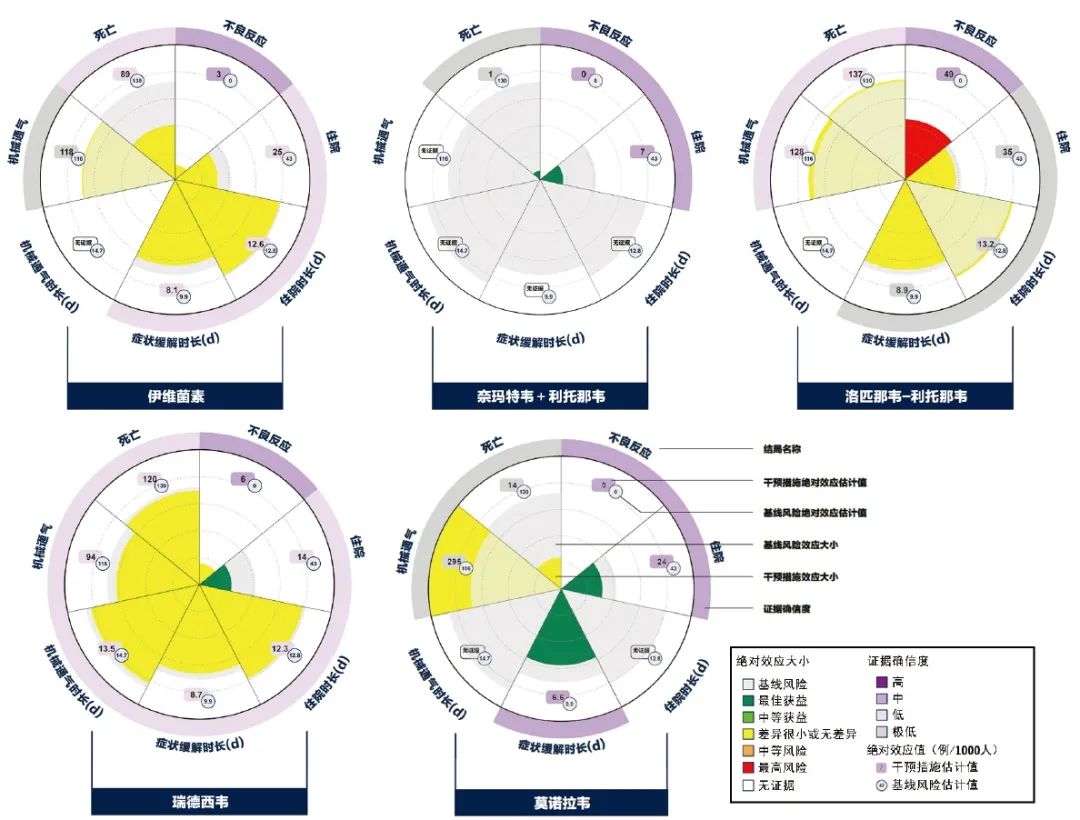
图1 5种药物治疗非重型COVID-19的证据汇总图
扇面区域内的彩色扇形示意干预措施的绝对效应估计值,灰色扇形示意对照措施或基线风险的绝对效应估计值,具体数值标识在扇面中。由于扇形半径的增加可导致面积平方倍增长,如半径从1个单位增加至4个单位,扇形面积将扩大至原本的16倍。因此,笔者建议设置扇形面积与效应值的大小应成比例。通过观察扇形面积,读者能够快速判断应用干预措施带来的效果变化水平;通过读取数值,读者能够对该效果形成明确概念。
使用符合直觉的颜色为扇形着色,能够直观反映潜在的获益与风险。如设置2个决策阈值,将效应划分为很小或无差异、中等、最高的获益与风险,采用黄色表示未达到MID的效应或不存在统计学差异的效应,浅绿色表示中等获益,深绿色表示最佳获益,橘色表示中等风险,红色表示最高风险。外围的环形区域用于呈现证据确信度的评估结果,证据确信度越高,填充颜色越深。通过观察所有扇面,读者能够迅速明确干预措施在各个结局上的利弊情况,并形成直观比较。在图形内部添加多个同心圆有助于比较不相邻的结局,但应注意对比关系只应建立在相同单位的结局之间。
2 案例演示
结合《世界卫生组织药物治疗COVID-19动态指南》[22]2023年1月更新版(下文简称“COVID-19指南”)进行实例演示。数据来源于指南配套动态网状Meta分析[23],选取其中5种药物治疗干预措施,包括莫诺拉韦、洛匹那韦-利托那韦(lopinavir-ritonavir)、伊维菌素(ivermectin)、奈玛特韦+利托那韦(nirmatrelvir and ritonavir)和瑞德西韦(remdesivir),以及7个患者重要结局(死亡、机械通气、不良反应、住院、机械通气时长、住院时长和症状缓解时长)。
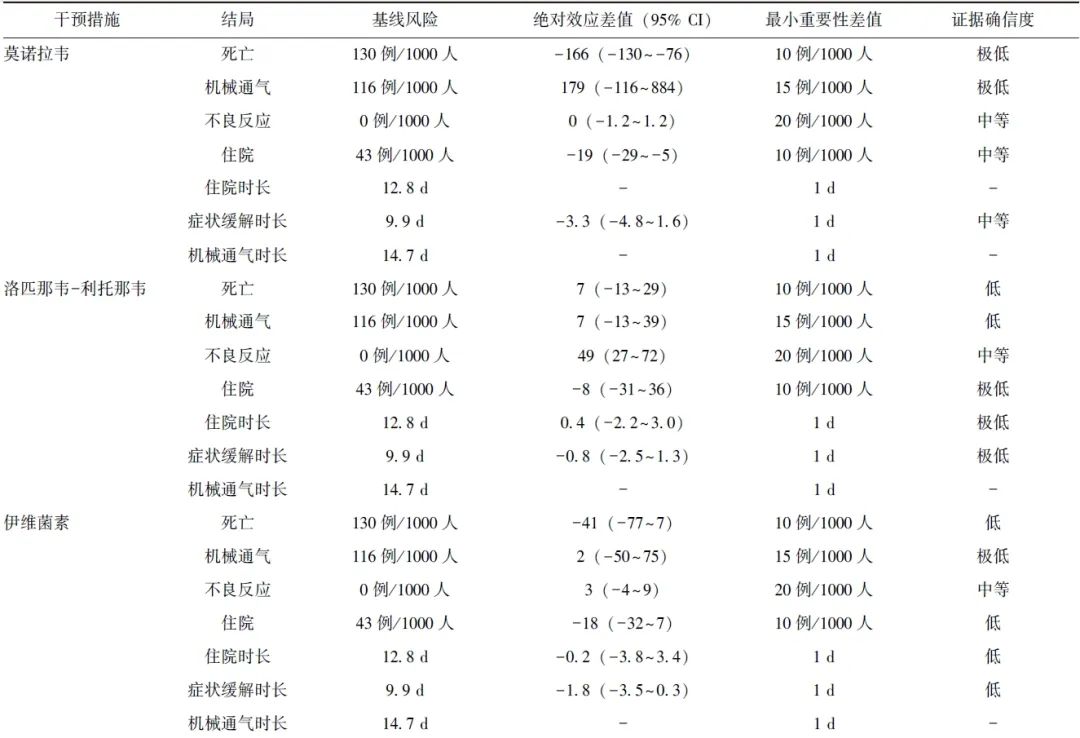
该网状Meta分析共纳入随机试验420项,其中死亡267项,机械通气140项,不良反应99项,住院35项,机械通气时长28项,住院时长113项,症状缓解时长79项。5种干预措施的主要证据信息见表1。
表1 5种药物治疗非重型COVID-19的证据汇总表

2.1 单项干预措施的证据汇总结果可视化
根据V plot思路绘制5种药物治疗非重型COVID-19的证据汇总图(图1)。以莫诺拉韦为例,V plot在绝对效应尺度上汇总呈现了莫诺拉韦在7个不同患者重要结局方面的效果。在各个结局对应的独立扇面中,利用扇形的面积和颜色,V plot直观地呈现了干预措施效应与基线风险(常规治疗)的大小和差异。
此外,通过颜色划分,证据确信度也一目了然。由图中可知:在常规治疗的非重型COVID-19患者中,每1000人中约43例可能住院;而中等确信度的证据表明,应用莫诺拉韦可避免其中19例患者住院,将住院患者人数降低至24例/1000人。扇形的深绿色表示,根据设定的决策阈值,减少19例/1000人的住院患者达到了“最佳获益”程度。同样地,中等确信度的证据提示,使用莫诺拉韦还可有效缩短症状缓解时长3.3 d,该效果亦具有较大临床价值。
在死亡、机械通气和不良反应结局中,莫诺拉韦与常规治疗的效应估计值相差较大,但效应却无统计学差异,可推测证据具有显著的不精确性(可信区间过宽);结合其极低的证据确信度,可推测该结论非常不可靠,即无法把握莫诺拉韦在死亡和机械通气结局上的利弊。此外,在机械通气时长和住院时长两个结局上,暂缺乏相关证据。
综上所述,有中等把握认为使用莫诺拉韦治疗非重型COVID-19能够在降低住院风险和缩短症状缓解时长上为患者带来较大获益,但无法确定其潜在风险。
2.2 多种干预措施的证据汇总结果可视化
得益于图形面积和颜色的视觉冲击性,V plot在传递多干预、多结局的复杂证据信息中可能更具优势。快速浏览图1即可获取以下信息:与常规治疗相比,应用洛匹那韦-利托那韦不仅不会带来获益,反而很有可能增加不良反应的发生风险;应用伊维菌素可能不会带来任何获益或风险;应用奈玛特韦+利托那韦、瑞德西韦、莫诺拉韦可能使患者获益。其中,低确信度的证据表明使用瑞德西韦可降低患者的住院风险,但在其他结局上的利弊尚无明显差异;关于莫诺拉韦的证据解读同上文;极低确信度的证据表明使用奈玛特韦+利托那韦可极大程度降低死亡风险,中等确信度的证据表明可大幅减少住院人数,且不会增加不良反应的发生风险。
综上所述,若5种药物在其他方面(如可及性、可接受性等)无明显差异,则可基于患者重要结局的证据情况,对药物治疗非重型COVID-19作出如下推荐:洛匹那韦-利托那韦弊大于利,作强不推荐;伊维菌素与常规治疗在获益方面基本无差异,但亦未明显增加风险,作弱不推荐;瑞德西韦可在降低住院风险方面带来最佳获益,但确信度低,作弱推荐;莫诺拉韦可在降低住院风险和缩短症状缓解时长方面带来最佳获益,但缺乏安全性把握,作弱推荐;奈玛特韦+利托那韦虽在4个患者重要结局方面缺乏证据支持,但其可在降低住院风险方面带来最佳获益,且具有较好的安全性,作强推荐。依据V plot反映的证据信息作出的推荐与COVID-19指南中的推荐意见一致。
2.3 功能延伸
根据具体的证据汇总呈现需求,研究者可对V plot进行个性化调试,以拓展和延伸相应功能。如通过划分区域,可汇总呈现干预措施在不同层面结局上的效果比较。常见情况包括呈现干预措施在不同人群、不同疾病时期的证据,从而支持具有区分度的推荐意见。
图2为瑞德西韦治疗重型和危重型COVID-19的证据汇总图。
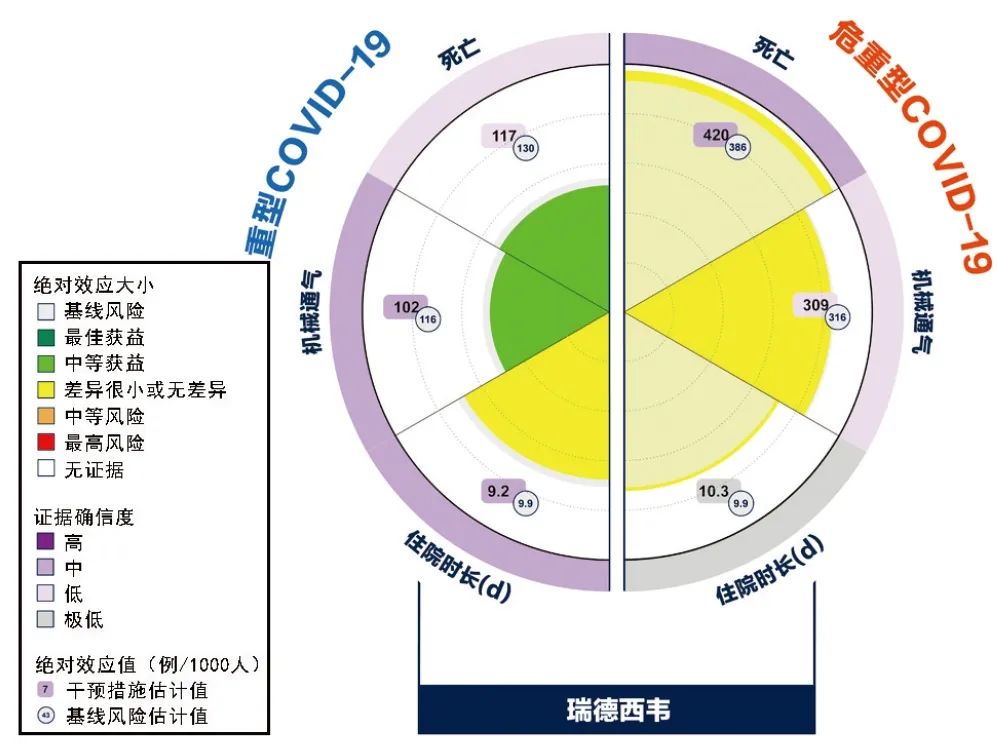
图2 瑞德西韦治疗重型和危重型COVID-19的证据汇总图
通过观察图形可知,对于不同疾病严重程度的COVID-19患者,应用瑞德西韦的潜在获益和风险不同。相较于常规治疗,低至中等确信度的证据表明,瑞德西韦治疗重型COVID-19可在降低死亡和机械通气风险方面带来中等获益,且无明显风险,作弱推荐;极低至中等确信度的证据表明,瑞德西韦治疗危重型COVID-19不会带来显著获益或风险,作弱不推荐。
3 注意事项
在实际操作中,研究者应注意以下问题。首先,当决策需权衡的关键信息过多时,可导致V plot扇面数量过多、各扇面夹角过小,视觉呈现冗杂拥挤,图形美观程度和信息有效传递能力降低。笔者建议在1个V plot中最多呈现10个不同结局,若结局数量过多可按重要性排序进行选择性呈现。
其次,当干预措施过多时,研究者应根据一定的规律整理V plot,将利弊权衡区分度低、更可能导致分歧意见的干预措施对应的V plot罗列在一起,以便于横向比较。
再次,研究者应向V plot的读者进行培训和说明,确保读者能够正确理解图形各部分的含义。
最后,V plot作为一种证据汇总的可视化工具,不能完全代替证据决策表等标准呈现形式,同时研究者应提供按照规范制作的证据汇总信息。
4 小结与展望
V plot的主要作用是促进和优化从证据至推荐这一过程,聚焦于全面、直观地传达决策所需的证据信息,帮助决策者在充分理解和综合把握多干预、多结局复杂证据的基础上作出合理的价值判断和选择。
V plot的首要应用情境是辅助指南推荐意见的形成和共识,简化和加速证据转化过程。在其他服务于决策的证据汇总中,如系统评价、证据传播等环节同样适用。笔者在既往发表的网状Meta分析研究中试验性地应用该工具,将主要证据汇总为直观、易懂的“可视化摘要”,实现了对研究结果的高效总结和呈现[24]。
基于证据作出推荐意见后,证据信息的传递并未结束。形成的推荐意见距离指导临床实践仍存在一段距离[25]。主流的指南报告规范RIGHT(Reporting Items for practice Guidelines in HealThcare)[26]和AGREE Ⅱ(Appraisal of Guidelines,Research and Evaluation Ⅱ)[27]均对推荐意见的清晰性、明确性作出了要求,其目的是确保推荐意见能够被指南使用者理解和应用。
然而,临床实际的复杂性加剧了推荐意见向实践转化的难度,尤其是在中医药、整合医学指南领域,立足整体观、考虑个性化的推荐意见通常相互交错,常出现一项干预措施对一组疾病有效、干预措施的联用能够提升疗效和减低毒副作用等情况[28]。因此,很有必要开发汇总推荐意见的可视化方法,以增强其理解度和可实施性。V plot作为一种直观展示证据汇总结果的可视化工具,可优化多干预、多结局复杂证据的呈现,提高证据传递的准确性、全面性、易读性,为促进循证决策提供帮助,值得推广应用。
参考文献
[1]Institute of Medicine (US) Committee on Standards for Developing Trustworthy Clinical Practice Guidelines. Clinical practice guidelines we can trust[M]. Washington, D.C.: National Academies Press, 2011.
[2]Guyatt G H, Oxman A D, Kunz R, et al. Going from evidence to recommendations[J]. BMJ, 2008, 336(7652): 1049-1051.
[3]陈耀龙, 杨克虎, 王小钦, 等. 中国制订/修订临床诊疗指南的指导原则(2022版)[J]. 中华医学杂志, 2022, 102(10): 697-703.
[4]Lin G A, Aaronson D S, Knight S J, et al. Patient decision aids for prostate cancer treatment: a systematic review of the literature[J]. CA Cancer J Clin, 2009, 59(6): 379-390.
[5]Andrews J, Guyatt G, Oxman A D, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations[J]. J Clin Epidemiol, 2013, 66(7): 719-725.
[6]Alonso-Coello P, Oxman A D, Moberg J, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines[J]. BMJ, 2016, 353: i2089.
[7]McCaffery K J, Dixon A, Hayen A, et al. The influence of graphic display format on the interpretations of quantitative risk information among adults with lower education and literacy: a randomized experimental study[J]. Med Decis Making, 2012, 32(4): 532-544.
[8]Feldman-Stewart D, Kocovski N, McConnell B A, et al. Perception of quantitative information for treatment decisions[J]. Med Decis Making, 2000, 20(2): 228-238.
[9]De Crescenzo F, D'Alò G L, Ostinelli E G, et al. Comparative effects of pharmacological interventions for the acute and long-term management of insomnia disorder in adults: a systematic review and network meta-analysis[J]. Lancet, 2022, 400(10347): 170-184.
[10]赖鸿皓, 王浙, 李滢, 等. 中医药多元证据整合方法学MERGE框架[J]. 协和医学杂志, 2024, 15(1): 172-182.
[11]Lai H H, Sun M Y, Pan B, et al. Comment on: ‘vitruvian plot: a visualisation tool for multiple outcomes in network meta-analysis'[J]. Evid Based Ment Health, 2022, 25(4): e5.
[12]Guyatt G H, Oxman A D, Santesso N, et al. GRADE guidelines: 12. Preparing summary of findings tables-binary outcomes[J]. J Clin Epidemiol, 2013, 66(2): 158-172.
[13]Zeraatkar D, Han M A, Guyatt G H, et al. Red and processed meat consumption and risk for all-cause mortality and cardiometabolic outcomes: a systematic review and meta-analysis of cohort studies[J]. Ann Intern Med, 2019, 171(10): 703-710.
[14]Jaeschke R, Singer J, Guyatt G H. Measurement of health status. Ascertaining the minimal clinically important difference[J]. Control Clin Trials, 1989, 10(4): 407-415.
[15]Brignardello-Petersen R, Florez I D, Izcovich A, et al. GRADE approach to drawing conclusions from a network meta-analysis using a minimally contextualised framework[J]. BMJ, 2020, 371: m3900.
[16]Brignardello-Petersen R, Izcovich A, Rochwerg B, et al. GRADE approach to drawing conclusions from a network meta-analysis using a partially contextualised framework[J]. BMJ, 2020, 371: m3907.
[17]Florez I D, Veroniki A A, Al Khalifah R, et al. Compara-tive effectiveness and safety of interventions for acute diarrhea and gastroenteritis in children: a systematic review and network Meta-analysis[J]. PLoS One, 2018, 13(12): e0207701.
[18]朱鸿飞, 栗梦婷, 后亮瑛, 等. 网状Meta分析结论形成的方法: 部分背景化框架[J]. 中国循证医学杂志, 2021, 21(9): 1110-1116.
[19]栗梦婷, 朱鸿飞, 后亮瑛, 等. 网状Meta分析结论形成的方法: 最小背景化框架[J]. 中国循证医学杂志, 2021, 21(9): 1102-1109.
[20]Balshem H, Helfand M, Schünemann H J, et al. GRADE guidelines: 3. Rating the quality of evidence[J]. J Clin Epidemiol, 2011, 64(4): 401-406.
[21]Ostinelli E G, Efthimiou O, Naci H, et al. Vitruvian plot: a visualisation tool for multiple outcomes in network meta-analysis[J]. Evid Based Ment Health, 2022, 25(e1): e65-e70.
[22]Lamontagne F, Stegemann M, Agarwal A, et al. A living WHO guideline on drugs to prevent COVID-19[J]. BMJ, 2021, 372: n526.
[23]Siemieniuk R A, Bartoszko J J, Zeraatkar D, et al. Drug treatments for COVID-19: living systematic review and network meta-analysis[J]. BMJ, 2020, 370: m2980.
[24]Sun M Y, Lai H H, Na F Y, et al. Monoclonal antibody for the prevention of respiratory syncytial virus in infants and children: a systematic review and network meta-analysis[J]. JAMA Netw Open, 2023, 6(2): e230023.
[25]赖鸿皓, 孙铭谣, 黄嘉杰, 等. 中西医结合临床实践指南实施框架构建的思考[J]. 协和医学杂志, 2023, 14(1): 31-38.
[26]Chen Y L, Yang K H, Maruic A, et al. A reporting tool for practice guidelines in health care: the RIGHT statement[J]. Ann Intern Med, 2017, 166(2): 128-132.
[27]Brouwers M C, Kerkvliet K, Spithoff K, et al. The AGREE reporting checklist: a tool to improve reporting of clinical practice guidelines[J]. BMJ, 2016, 352: i1152.
[28]Greenlee H, DuPont-Reyes M J, Balneaves L G, et al. Clinical practice guidelines on the evidence-based use of integrative therapies during and after breast cancer treatment[J]. CA Cancer J Clin, 2017, 67(3): 194-232.
作者:协和医学杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





#循证决策# #可视化工具# #维特鲁威图#
47