II期临床研究表明:激活iNKT细胞令肺癌患者生存期达21.9个月,疾病控制率42.9%,疗法安全耐受性好
2024-07-22 《基因启明》公众号 《基因启明》公众号
据统计,每年约有160万肺癌患者因病去世,其中,非小细胞肺癌(NSCLC)约占所有原发肺癌的85%,且大多数患者在诊断时已是晚期,预后较差。
亮点
1. 激活iNKT细胞后,晚期NSCLC患者的生存期长达21.9个月,1年生存率高达84.4%,近半数患者病灶病变稳定。
2. 激活iNKT细胞后,患者体内免疫细胞亚群数量大幅增多,超半数患者患者产生IFN-γ的细胞数量增加1.9倍,2年生存率高达50.0%。
3. 接受激活iNKT细胞疗法的患者未观察到严重不良事件,轻微不良症状会随着时间推移或人为干预得以消退,安全性良好。

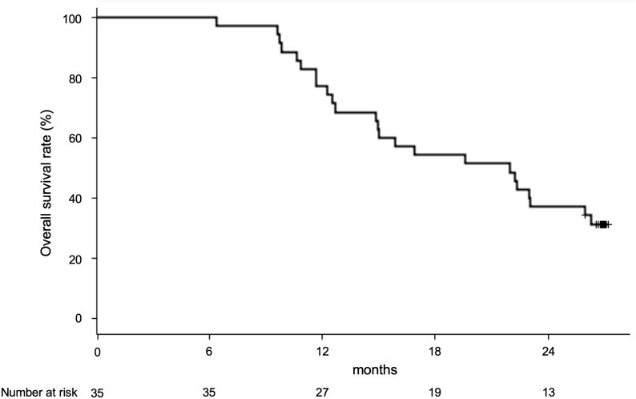
激活iNKT细胞后患者的总生存期
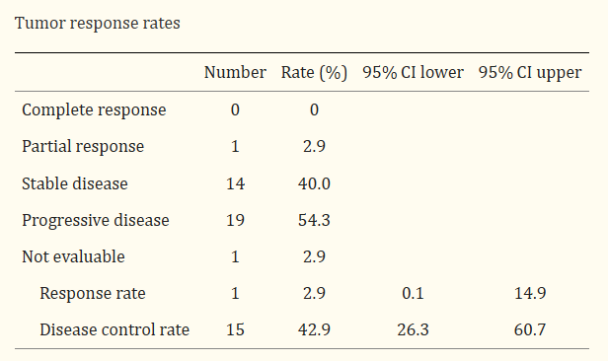
肿瘤反应率
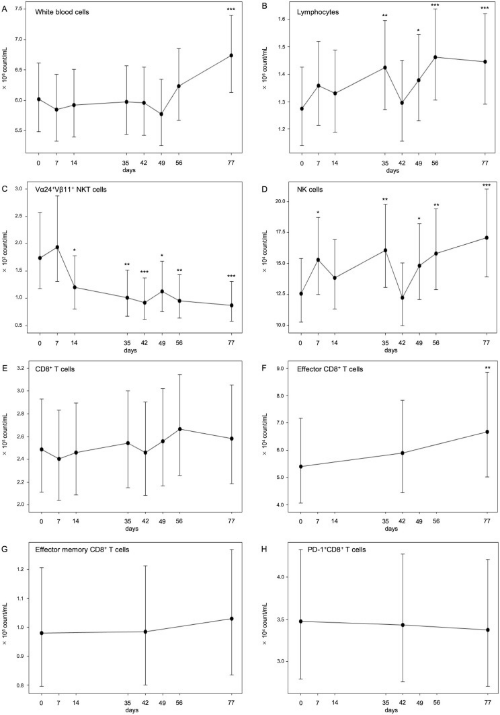
患者的免疫学监测
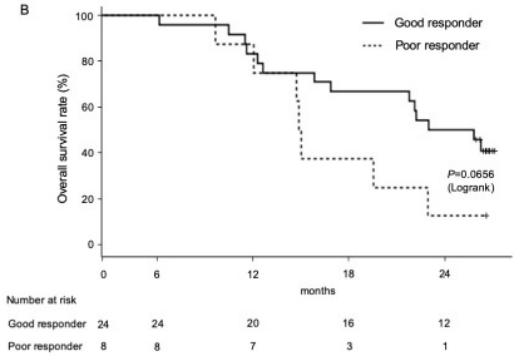
良好应答者和不良应答者的总生存期比较
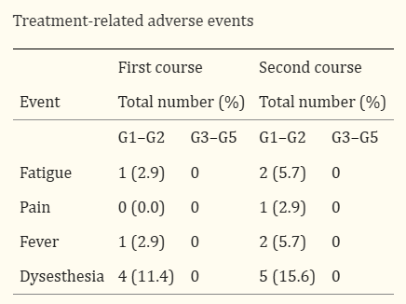
治疗相关不良事件
来源:
微信公众号: 基因启明
参考文献
Toyoda T, Kamata T, Tanaka K, Ihara F, Takami M, Suzuki H, Nakajima T, Ikeuchi T, Kawasaki Y, Hanaoka H, Nakayama T, Yoshino I, Motohashi S. Phase II study of α-galactosylceramide-pulsed antigen-presenting cells in patients with advanced or recurrent non-small cell lung cancer. J Immunother Cancer. 2020 Mar;8(1):e000316. doi: 10.1136/jitc-2019-000316. PMID: 32188702; PMCID: PMC7078938.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#非小细胞肺癌# #肺癌#
83