FDA批准首个相关口服疗法voclosporin背后,狼疮肾炎未来创新路在何方?
2022-10-10 九尾灵狐 同写意
目前狼疮性肾炎(lupus nephritis,LN)的治疗并不令人满意,只有20-30%的患者在6-12个月内获得完全肾脏缓解,5-20%的患者在10年内发展为终末期肾脏疾病。两种药物(belimu
目前狼疮性肾炎(lupus nephritis,LN)的治疗并不令人满意,只有20-30%的患者在6-12个月内获得完全肾脏缓解,5-20%的患者在10年内发展为终末期肾脏疾病。两种药物(belimumab和voclosporin)已被医疗机构正式注册为LN的补充治疗药物。其他靶向治疗药物(obinutuzumab和anifrolumab)在II期研究中取得了令人感兴趣的结果,目前正在进行III期试验。最近的临床试验为LN的治疗开辟了新的途径,有望降低慢性肾脏疾病的发病率。voclosporin是FDA批准的首个狼疮肾炎口服疗法,2022年9月19日,欧盟委员会也批准了voclosporin的上市许可,用于治疗活动性狼疮肾炎。
LN和SLE的关系:LN是系统性红斑狼疮(SLE)最常见、最重要的内脏并发症,是导致SLE患者死亡的主要原因。35-60%的患者被描述为肾脏损害。至少20%的LN患者会发展为慢性肾病(CKD),其定义为肾小球滤过率(eGFR)< 60 ml/min/1.73 m2,5-20%的患者将需要肾脏替代治疗,伴随着发病率和死亡率增加,以及巨大的社会经济负担。[1]
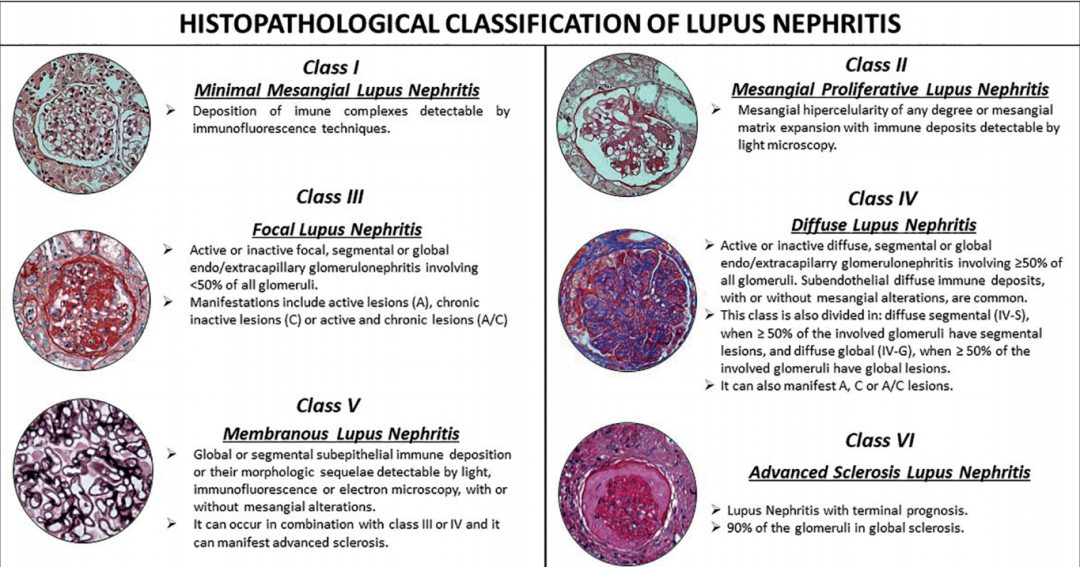

LN的临床实践指南及推荐用药:2012年欧洲风湿病联盟-欧洲肾脏协会-欧洲透析和移植协会(EULAR/ERA-EDTA)制订了针对LN的联合推荐意见。随后,出现了很多新的研究进展,包括钙调磷酸酶抑制剂(CNI)和“多靶点”疗法等。2019年5月,EULAR/ERA-EDTA专家组对2012年推荐意见进行了重新评估和相应修订,并通过证据等级和推荐强度方法来提高整体证据可信度和临床适用性。2019年12月我国重新修订了中国 LN诊治指南,在原有指南基础上,修订部分意见,并增加了“狼疮足细胞病”和“狼疮血栓性微血管病”2 个病理类型,旨在提高中国LN的治疗疗效。
LN的六种病理分型:Ⅰ类LN不需要特殊处理,仅给予基础用药羟氯喹,可考虑小剂量泼尼松(prednisone,PED);Ⅱ型伴持续性/严重蛋白尿时指南一致推荐联用免疫抑制剂;Ⅲ、Ⅳ型LN治疗分诱导和维持两个阶段,即诱导阶段采用MMF/CTX,联用糖皮质激素;维持阶段MMF或者硫唑嘌呤(azathioprine,AZA),并减量糖皮质激素;Ⅴ型LN,国外指南推荐诱导治疗推荐先静脉大剂量激素冲击,联用MMF,然后口服激素并逐渐减量;Ⅵ型LN为终末阶段,如果出现明显肾功能衰竭,则推荐肾脏替代治疗。[3]
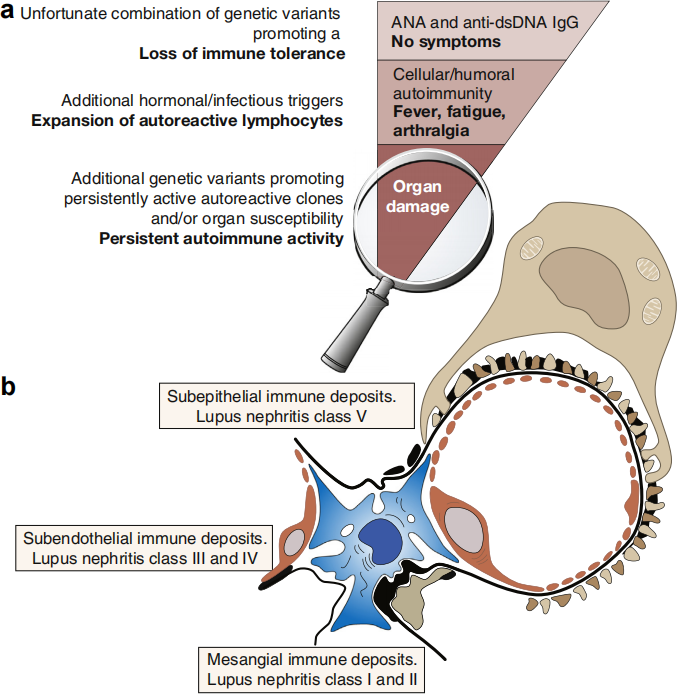
LN的病理生理学概述:LN不仅仅被认为是一种肾小球疾病(肾小球肾炎),也是一种影响所有肾脏腔室的疾病(pan-nephritis)。肾小球的成分是由循环免疫复合物(IC)的内皮下、上皮下和系膜沉积引起的。内皮下IC诱导内皮功能障碍和免疫细胞(如T细胞和巨噬细胞)在肾小球簇中的募集,而上皮下(和系膜)IC损伤足细胞,足细胞在维持肾小球完整性中起核心作用。除了肾小球成分,肾小管间质(TI)的炎症和损伤也发挥了关键作用。位于小管和管状毛细血管旁的驻留巨噬细胞也被IC激活。这一过程导致肾抗原的释放,这些抗原被提呈给局部免疫效应物,如树突状细胞,从而诱导局部免疫反应。TI炎症进一步导致缺氧、纤维化和肾小管萎缩。
多项研究报道LN的长期预后在很大程度上受TI的炎症、纤维化和萎缩程度的影响。图2a中倒三角表示该综合征各阶段的患病率。在肾脏内部,LN是一种免疫复合物肾小球肾炎。其他类型的肾损伤可发生在单独的狼疮患者或狼疮肾炎患者中,包括血栓性微血管病和肾血管炎。图2b中,根据免疫复合物积聚的位置定义了狼疮性肾炎的不同组织病理学分类。这些分类在预后和处理方面不同,所以通常需要肾活检。[4]
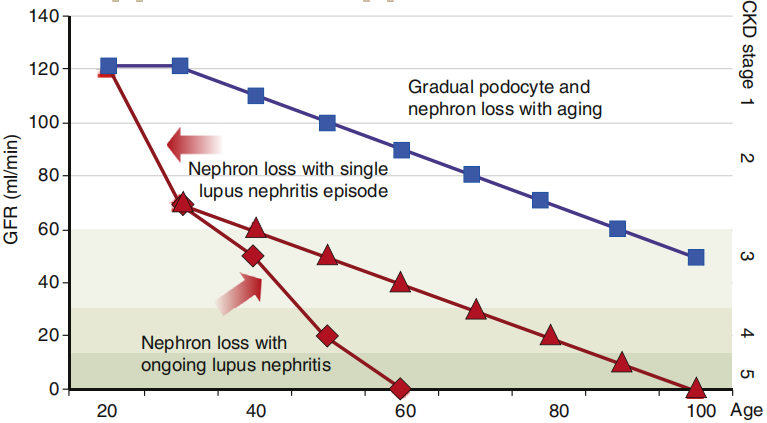
LN的治疗策略:如表1,人在40岁左右开始失去足细胞(以及相应的肾元),因此导致eGFR平均下降0.7 ml/min/m2/年。LN的发作大大加快了这一过程。由于该疾病主要发生在年轻(女性)成年人(有时也发生在儿童),在生命早期发展为慢性肾病(CKD)甚至终末期肾病(ESKD)的风险很高。因此,LN的治疗可以看做对抗不可逆肾单位损失的短跑比赛,最终目标是在最初肾损伤后几十年避免CKD。目前预防LN进展为CKD的治疗模式,包括一个初始(诱导)治疗以诱导缓解和一个后续(维持)治疗以维持缓解。
基于这些原则,协会(EULAR/ERA-EDTA)于2019年联合制定并更新了LN的治疗建议。工作组建议使用静脉注射(IV)甲基泼尼松龙(MP)脉冲,然后中等剂量口服泼尼松龙(0.3-0.5 mg/kg/天),三个月后迅速减少到≤5-10 mg/天。根据Euro-Lupus方案(6×500 mg q2w),霉酚酸酯(MMF;2-3 g/天)或低剂量IV环磷酰胺(CYC),作为诱导治疗的首选。建议使用RAS抑制剂、体重控制、减少盐摄入量、最佳血压控制、避免吸烟和避免使用肾毒性药物来实现最佳的肾脏保护。羟氯喹(HCQ)最初开发用于治疗皮肤和关节受累,是 LN 中的另一种重要药物,它能降低肾病、ESKD和死亡风险。
一旦有缓解,建议使用MMF或硫唑嘌呤(AZA)维持免疫抑制治疗。可使用MMF作为诱导治疗。在使用 IV CYC 进行初始治疗的情况下,应继续使用 MMF 或 AZA 进行维持。维持性免疫抑制治疗应至少3年。完全缓解且无肾外表现的患者应停用类固醇。
根据几个回顾性研究,在难治性病例中建议使用利妥昔单抗,这是一种B细胞消耗性抗CD20单克隆抗体。
在LN中,反复测量全血HCQ滴度非常有助于识别不依从患者,否则这些患者将被认为是难治性病例,暴露于治疗升级,伴有更多的免疫抑制和可能的额外不良事件。提高治疗依从性是困难的,需要涉及护士、心理学家和其他卫生专业人员的多学科方法。
LN应该通过定期的蛋白尿评估尽早诊断。当检测到蛋白尿时,肾脏的免疫过程已经工作了几个月,甚至几年。这可能解释了为什么一些“新”诊断的LN患者在最初的活检中已经显示出一些慢性损伤,如肾小球瘢痕和肾小管间质纤维化。这些慢性变化可能会危及标准免疫抑制剂和新靶向治疗的有效性。
尽管与上个世纪相比,患者和肾脏存活率有了很大的提高,但由于类固醇和其他免疫抑制剂的使用,在6-12个月的治疗后,只有20-30%的患者实现了完全肾缓解(CRR),定义为蛋白尿≤0.5 g/天。最近的一项研究表明,未经历CRR的LN患者患CKD的风险增加3倍,ESKD的风险增加10倍。20-35% 的LN患者出现发作。更令人担忧的是,如上所述,近20%的LN患者会发展为CKD,5-20%的患者在15年后需要肾脏替代治疗。除了这些不理想的结果之外,目前的治疗方案,特别是类固醇的副作用,极大地降低了生活质量,引起不可逆转的器官损伤(如椎体挤压、骨坏死、白内障、皮肤萎缩等),并增加发病率和死亡率。综上所述,这些数据说明存在未满足的临床需求。下文讨论了三种新疗法: treat-to-target,从序贯疗法切换到联合治疗(两种药物被官方标记为LN的附加治疗)和使用钠-葡萄糖共转运体2(SGLT-2)抑制剂。[1]
Treat‑to‑Target概念:该概念源于这样一种假设,即在疾病发作和初始治疗后尽早实现给定的目标,将确保在缺乏症或肾损害的情况下取得良好的长期结果。LN的复杂性和异质性使得这一目标比高血压、糖尿病或类风湿关节炎更难以定义。多年来,一直使用一个临床目标,即蛋白尿减少。然而,基于最近的几项研究,建议应该从临床目标转向病理目标,在治疗一年后通过 per-protocol重复进行肾活检。
蛋白尿减少作为临床目标是否合适?在治疗12个月后,蛋白尿减少到≤ 0.7-0.8 g/天,对良好的长期肾脏预后(即7年随访后无肾损害)具有极好的阳性预测价值。这在南美洲收集的真实世界LN的临床中得到了证实。因此,在病床上,人们可以让达到这一目标的患者放心,她/他将不会再患CKD。遗憾的是,阴性预测值非常低,因为三分之二没有达到这一目标的患者仍然实现了相同的目标。因此,问题在于尽早识别那些尚未达到临床目标的患者,以及那些将经历较差的长期肾脏预后的患者,对他们来说改变治疗可能是合适的。
肾活检与临床病理缓解:最近的研究,进行了三个不同的组,揭示了临床和病理缓解之间的不匹配诱导治疗。在诱导治疗后,无论临床缓解如何,通过per-protocol重复的肾活检,几乎三分之一的CRR患者显示了活动性LN的组织学征象。使用类似的设计,在6个月后进行的诱导肾活检中,50%的CRR患者的活动指数(AI)为 > 3。Parodis等人(2020年)分析了Louvain事件LN队列治疗12-24个月后按方案进行的重复肾活检,进一步强调了这种不匹配。虽然重复活检时测出的蛋白尿量与活动指数之间有轻微的相关性,但可以鉴定为两组患者。一些患者没有肾脏活动的迹象,但可能由于慢性损伤而持续存在显著的蛋白尿。那些患有慢性损伤但没有炎症的患者的风险是过度治疗。其他患者,尽管有低级别蛋白尿,但AI > 3,有治疗不足的风险。有趣的是,重复肾活检预示复发和长期肾脏预后。因此,AI > 3(主要在肾小球室)患者更常见肾脏疾病,而CKD与慢性指数(主要与肾小管间质有关)> 3相关。
肾活检相对蛋白尿更可靠:总的来说,我们建议在治疗一年后对LN进行系统的重复肾活检。可根据国际协议(http:// www.rebiolup.com),对活检结果和后续治疗如何改变的了解可增加CRR,从而改善长期预后。
最近两项III期随机对照试验的结果为LN的治疗策略开辟了一条新途径。两种药物(Belimumab和voclosporin)已被医疗机构列为用于LN的联合治疗。
Belimumab(BEL)优于类固醇:BEL是一种抗BLyS /BAFF单克隆抗体,最初于10多年前注册,用于非肾性SLE患者的附加治疗,基于6项随机对照试验。根据对两个关键试验中随机出现一定程度蛋白尿(未发生完全LN)且BEL改善的患者的回顾性分析,设计了一项III期LN试验(BLISS-LN)。患者在标准护理(SOC)的基础上接受BEL或安慰剂(PBO)治疗,即类固醇和MMF或Euro-Lupus IV CYC。104周后,主要由蛋白尿(≤0.7 g/天)驱动的主要终点(主要有效肾缓解)分别在32%和20%的BEL和PBO患者中达到。43%和30%的BEL和PBO患者达到CRR(蛋白尿≤0.5 g/d)。这些差异具有统计学意义。重要的是,BEL患者6 ~ 24个月的eGFR斜率在统计学上降低。这种作用的机制可以通过BEL治疗后的重复肾活检研究来阐明。BEL组更多的患者在第104周服用≤7.5 mg/天的强的松。从统计上看,BEL患者从第24周开始到首次肾移植的时间更长。BEL显著改善血清标志物,如抗DNA抗体和补体水平。也就是说,在IV CYC、V级LN和非洲患者中,没有统计上的显著益处。不良事件在BEL组也不常见。
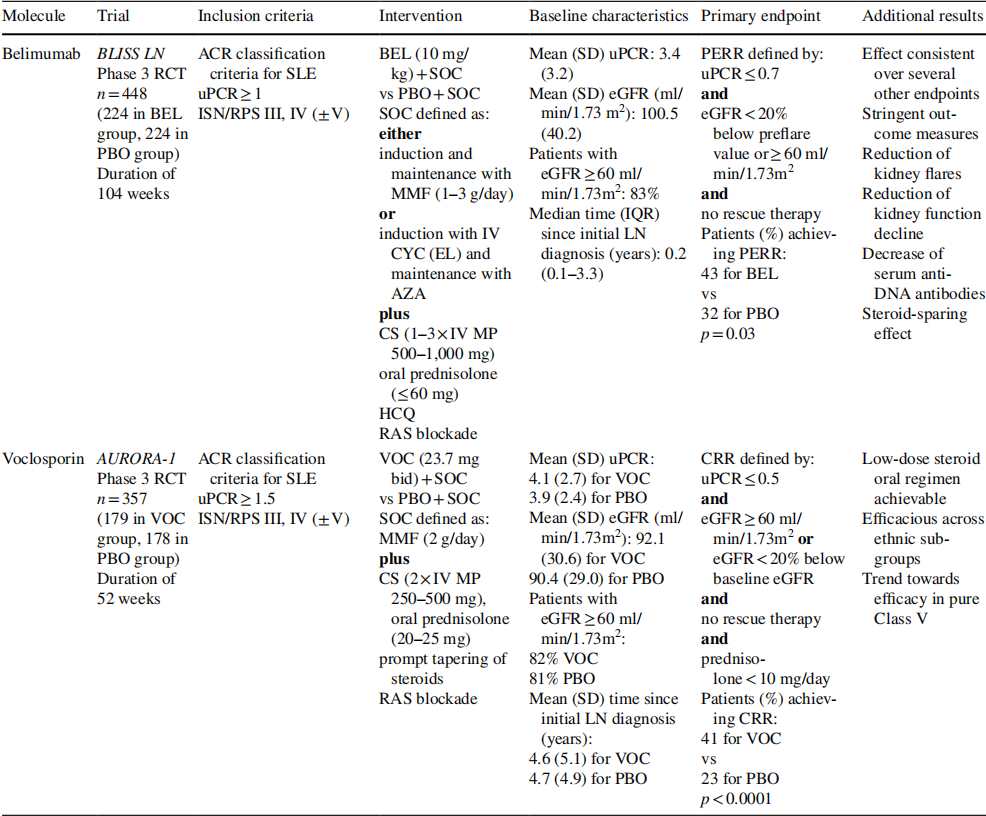
CNI的作用模式可迅速减少蛋白尿:Voclosporin(VOC)是钙调神经磷酸酶抑制剂(CNI),与他克莫司和环孢素类似。这些药物具有免疫抑制作用,并具有稳定足细胞肌动蛋白细胞骨架的独特能力(通过阻止突触肽去磷酸化),从而减少蛋白尿。与其他CNI相比,Voclosporin具有良好的药代动力学特性(无需药物监测)和对脂质和糖代谢的中性作用。CNI用于LN已有多年,尤其是亚洲患者,多与MMF联合使用。在成功进行了二期AURA-LV试验后,在另一项阳性III期试验(AURORA)中试验了VOC。患者在类固醇和MMF的基础上给予VOC(23.7 mg bid或PBO)治疗。值得注意的是,类固醇减量方案非常严格,16周时强的松的目标剂量为2.5 mg/天。41%的VOC患者和23%的PBO患者达到了主要终点(52周CRR)。正如CNI的作用模式所预期的那样,蛋白尿的减少是非常迅速的。VOC在不同的种族群体中表现出效果,包括非洲裔和西班牙裔/拉美裔患者。eGFR在两组中都保持稳定。对血清学生物标志物没有显著影响。不良事件在VOC组并不常见。VOC是FDA批准的首个狼疮肾炎口服疗法,2022年9月19日,欧盟委员会也批准了VOC的上市许可,用于治疗活动性狼疮肾炎。表2对两种新获批药品进行了比较。在II期研究获得良好的初始信号后,其他靶向治疗目前也正在与SOC联合进行III期试验,如obinutuzumab(OBI)和anifrolumab(ANI)。
OBI正处于三期临床中评价对LN的效果:OBI是一种抗cd20单克隆抗体,已被批准用于治疗慢性淋巴细胞白血病和滤泡性淋巴瘤。在NOBILITY II期试验中,患者(主要为西班牙裔)在MMF和类固醇的基础上接受OBI或PBO治疗。第52周(主要终点)、76周和104周时,PBO组的CRR率分别为23%、18%和23%,OBI组的CRR率分别为35% (p=0.11)、38%(p=0.011)和41%(p=0.026)。在OBI治疗的患者中,外周血B细胞(CD19+计数≤5细胞/µl)在第52周时达到94%。OBI组的不良事件并不多见。在目前招募的III期试验(REGENCY)中,患者在第0、2、24、26、50和52周接受OBI,并在第76周评估主要终点(CRR)。
anifrolumab正处于三期临床中评价对LN的效果:ANI是一种抗IFN -α和β受体亚基1(IFNAR1)单克隆抗体,阻断所有1型IFN(α, β, ε, κ, ω)的活性。基于这些细胞因子在SLE病理生理学中发挥的关键作用,ANI在两项非肾脏试验中得到成功测试:TULIP-1和TULIP-2。这些结果使得FDA最近批准ANI用于非肾性SLE,并促进了LN(TULIP-LN)的II期对照研究。在这项试验中,患者接受PBO或ANI治疗,后者遵循基础(较低)或强化(较高)方案,同时使用MMF和类固醇。只有接受强化方案的患者比PBO患者表现出更多的临床缓解。一项III期临床试验正在进行,该试验使用强化ANI疗法。
针对补体的药物,如C5aR拮抗剂或B因子抑制剂可能对LN有重大影响。这些药物,通过在级联下游的作用,可能显示出一种迅速的效果,允许严格减少甚至避免类固醇,正如最近在ANCA相关的血管炎中所证明的那样。又如诺华的LNP023,这是一款口服,特异性,FIC的补体因子B抑制剂,可通过靶向补体替代信号通路,阻断血管内和血管间溶血,目前在三期临床中评价对C3G患者的有效性和安全性,其LN的适应症正处于临床二期。
虽然缺乏LN的具体数据,最近一项用达格列净(DAPA)(SGLT-2抑制剂)治疗CKD患者的试验结果值得我们高度关注。在DAPA-CKD试验中,4304例eGFR在25~75 ml/min/1.73 m2体表面积和蛋白尿的患者接受DAPA (10 mg/day)或PBO治疗。大多数患者(67%)患有糖尿病。虽然排除了LN和血管炎患者,但纳入了其他肾小球疾病,如IgA肾病患者。该试验的终点是一个复合终点,包括:eGFR持续下降至少50%、终末期肾病、心肾原因死亡。试验在32个月后停止,中间分析显示DAPA组的主要结果降低了34%。SGLT-2抑制剂对肾小球疾病存在一定的作用,就像30年前的RAS抑制剂一样。
SGLT-2抑制剂的作用模式是复杂的,还有很多未解之处。在慢性肾小球疾病中,未受影响的肾单位存在过度滤过,这增加了近端小管的钠再吸收,从而降低远端小管和致密斑的钠水平。这导致传入小动脉通过小管-肾小球反馈进一步血管扩张(恶性循环)。通过阻断近端小管的钠(和葡萄糖)重吸收,增加远端小管和致密斑的钠含量,SGLT-2抑制剂诱导传入小动脉血管收缩,减少过度滤过并恢复小管肾小球反馈。
目前的联合治疗最多只能使41%的LN患者达到CRR,这表明仍有改善的空间。我们怎样才能进一步推动这些数字呢?为了实现这一目标,应该更多地关注坚持治疗和非免疫抑制治疗。
在12-24个月时 CRR 为10-20% ,这是否会在长期内转化为更少的 CKD/ESKD?数据表明,从未实现CRR的患者的肾脏预后较差。在这方面,提高CRR率应该对长期预后有积极影响,但只有进一步的随访才能提供答案。
我们是应该预先(上文讨论的临床试验中)开这些药物,还是在对SOC没有早期缓解迹象的患者开始使用这些药物前等待两到三个月?在最近的一篇综述中[5],后者的建议针对的是诱导治疗8-12周后,与基线相比,蛋白尿没有减少至少25%的患者,有错过机会窗口期的风险。至少在白种人患者中,大多数患者的早期缓解迅速(蛋白尿>降低25%)可能与静脉MP脉冲的迅速疗效有关。如果应用这样的规则,这些患者将无法从新治疗中受益。
会不会过度治疗病人?除非我们有有效的组织、血液或尿液生物标志物,能够在基线时识别那些对SOC无反应的患者,否则我们很可能会过度治疗相当一部分患者。另一方面,药物经济学方法应评估联合治疗的经济负担与肾脏替代治疗可能节省的费用。
BEL或VOC对严重肾功能损害患者的疗效如何?eGFR<30 ml/ min/m2的患者确实被排除在BLISS-LN,AURA-LV和AURORA。对于肾功能严重受损的患者,不建议使用CNIs,至少在肾功能改善之前,如静脉MP脉冲后。
另一方面,当几种阻断不同通路的药物问世时,下一个亟待解决的问题将是如何选择对特定患者的最佳治疗方案,因为“一种方法不能适用于所有人”。我们的选择将根据患者的肾外疾病(BEL可能在全身表现的情况下更有指示性)、患者的特异性毒性概况、药物的可获得性等进行指导。精准医学和治疗将取代间接的生物标志物的使用,如蛋白尿,虽然它也反映了炎症和慢性损伤。转录组学[6]和遗传变异可能会在评估CKD的个体风险中发挥作用,并允许采用量身定制的方法。
经过几十年未注册药物的使用和多次临床试验的失败,可以预见LN患者的未来会更好。
1,Pauline M. Montigny et al; New Treatment Options in Lupus Nephritis.Archivum Immunologiae et Therapiae Experimentalis (2022) 70:11.
2,Sergio Veloso Brant Pinheiro et al; Pediatric lupus nephritis.DOI: 10.1590/2175-8239-JBN-2018-0097.
3,FENG Xiaowen et al; Methodological quality assessment of clinical guidelines and consensus for lupus nephritis. DOI:10.7507/1672-2531.202108144.
4,Brad Rovin et al; A pathophysiology-based approach to the diagnosis and treatment of lupus nephritis.doi.org/10.1016/j.kint.2016.05.017.
5,Mejia-Vilet JM et al (2021) The lupus nephritis management renaissance. Kidney Int S0085–2538:00874–00877. https://doi.org/10.1016/j.kint.2021.09.012.
6,Crickx E et al (2021) Molecular signatures of kidney antibody-secreting cells in lupus patients with active nephritis upon immunosuppressive therapy. Arthritis Rheumatol 73:1461–1466. https://doi.org/10.1002/art.41703
作者:九尾灵狐
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#voclosporin#
107
#期刊论坛#!!!!
142
目前#狼疮性肾炎#(lupus nephritis,LN)的治疗并不令人满意,只有20-30%的患者在6-12个月内获得完全肾脏缓解,5-20%的患者在10年内发展为终末期肾脏疾病(#肾衰#。两种药物(#belimumab#和#voclosporin#)已被医疗机构正式注册为LN的补充治疗药物。其他靶向治疗药物(#obinutuzumab#和#anifrolumab#)在II期研究中取得了令人感兴趣的结果,目前正在进行III期试验。最近的临床试验为LN的治疗开辟了新的途径,有望降低慢性肾脏疾病的发病率。voclosporin是FDA批准的首个#狼疮肾炎#口服疗法,2022年9月19日,欧盟委员会也批准了voclosporin的上市许可,用于治疗#活动性狼疮肾炎#。#FDA#
161
目前#狼疮性肾炎#(lupus nephritis,LN)的治疗并不令人满意,只有20-30%的患者在6-12个月内获得完全肾脏缓解,5-20%的患者在10年内发展为终末期肾脏疾病(#肾衰#。两种药物(#belimumab#和#voclosporin#)已被医疗机构正式注册为LN的补充治疗药物。其他靶向治疗药物(#obinutuzumab#和#anifrolumab#)在II期研究中取得了令人感兴趣的结果,目前正在进行III期试验。最近的临床试验为LN的治疗开辟了新的途径,有望降低慢性肾脏疾病的发病率。voclosporin是FDA批准的首个#狼疮肾炎#口服疗法,2022年9月19日,欧盟委员会也批准了voclosporin的上市许可,用于治疗#活动性狼疮肾炎#。
128