Cancer Med:112例治疗相关AML的真实世界治疗模式临床结局
2023-08-13 聊聊血液 聊聊血液
该研究分析了两个法国中心的112例连续t-AML患者的原发性恶性肿瘤的一般特征和治疗方式,并根据治疗方式和预后因素分析其临床结局。
治疗相关AML
治疗相关髓系肿瘤 (t-MN) 包括治疗相关急性髓系白血病 (t-AML) 和治疗相关骨髓增生异常综合征 (t-MDS) ,为原发性恶性肿瘤治疗后出现的髓系肿瘤,特征为预后不良。在新诊断的 AML 和 MDS 病例中,分别有10%和20%与治疗相关,通常是独立的不良预后因素。治疗相关 AML 是细胞毒治疗和/或靶向治疗诱导突变事件的直接结果,很可能由既存疾病如克隆性造血所促进。随着原发癌的生存期延长,t-MN的发生率也在增加,因此更好地描述与该疾病相关的生物学和预后因素非常有必要。
近日《Cancer Medicine》发表一项回顾性研究,分析了两个法国中心(一个大学医院和一个癌症中心)的112例连续t-AML患者的原发性恶性肿瘤的一般特征和治疗方式,并根据治疗方式和预后因素分析其临床结局。

研究结果
研究回顾性纳入两个法国中心共112例根据2016年修订版 WHO 标准诊断为 t-AML且发生于实体瘤 (ST)、恶性血液病 (HM) 或自身免疫性疾病 (AID) 治疗后的成人患者。
患者特征
在纳入研究的112例患者中,56例为男性 (50%),诊断为 t-AML 时的中位年龄为68岁 (19-87)。在 t-AML 之前,108例患者出现首次肿瘤:73例患者为ST(64.5%),35例为HM(30.5%),其中6例患者 (5.4%) 发生了第二次肿瘤(ST 4例,HM 2例);此外4例患者既往为AID(3.6%)。46例患者 (41%) 曾接受原发疾病化疗(烷化剂、拓扑异构酶 II 抑制剂单药或联合或其他药物)、17例 (15%) 接受放疗、49例(44%) 接受放化疗;17例患者 (15%) 在大剂量化疗(2例 ST 和15例HM)后接受了Auto-HCT。AID 后t-AML 均接受过长期甲氨蝶呤治疗。从既往ST、HM和 AID 治疗至 t-AML 诊断的中位间隔时间为5.3年 (0.4-34.3)(表1)。

AID 后t-AML 与 ST 和 HM 人群具有相似的特征,包括至t-AML时间、人口统计学和遗传学特征、治疗反应和结局方面。在 t-AML 诊断时,44例 (42%) 患者的细胞遗传学高危,包括28例 (64%) 为复杂核型、16例为非复杂核型(3例患者为 5q 缺失、5例为7号单体、3例为 7q 缺失、2例为两种染色体异常、3例为其他异常)。9例患者呈17号染色体异常(2例缺失,7例单体),均属于复杂核型。t-AML 核型方面,在中危患者中,ST后观察到70%的患者为既往ST,17%为HM,13%为AID;在高危患者中,59%为ST,41%为HM (p=0.03)。
分子学改变,分别有6.9%、2.3%、11.5%和2.3%的患者携带FLT3-ITD、FLT3-TKD、NPM1和 IDH 突变。25%(22/88) 的患者MECOM1 过表达,MECOM1 过表达分别与9/22(40.9%) 和3/22(13.6%) 患者的 11q23 和3号染色体重排有关。根据 2010 ELN 分类,低危、中危(1和2)和高危患者比例分别为11%、45%和44%。
仅13例患者进行NGS监测,中位突变数为2(1-5),复杂核型患者的突变负荷(中位1.9[1-3])低于非复杂核型患者(中位3.2[1-5];p=0.17)。TP53 突变在该 t-AML 人群中高度富集 (6/13),包括3例携带17号染色体异常的患者(1例复杂核型患者和2例中间核型患者)。TP53 突变患者与 RTK 通路突变,尤其是 RAS 通路有很强的共存性。
总体而言,分别有55例 (49%) 和33例 (29.5%) 接受强化化疗(IC)和非IC [24 例 (21.5%)去甲基化药物和9例 (8%)低剂量阿糖胞苷],24例患者 (21.5%) 未接受治疗,因此接受了最佳支持治疗。在接受治疗的患者 (n=88)(IC+非IC)中,43例患者 (49%) 达到CR:非 IC 患者4/33例 (12%)(去甲基化药物中3例,低剂量阿糖胞苷中1例)和 IC 患者39/55例 (71%)。15例患者 (17%) 接受了Allo-HCT,AML诊断和 Allo-HCT 之间的中位时间间隔为4.7个月 (2.6-17.5)(表1)。
临床结局
中位随访5.5个月,整个人群的中位 OS 和治疗人群的 DFS 分别为9个月和6.3个月(图1A,B)。三组之间(整个人群:最佳支持治疗 vs.非IC vs. IC)的OS(p<0.001),以及 IC 组(中位14.8个月)和非 IC 组(中位11个月)之间的OS (p=0.02) 存在显著差异(图1C)。IC 组(中位10.3个月)和非 IC 组(中位8个月)的 DFS 无差异(图1D)。
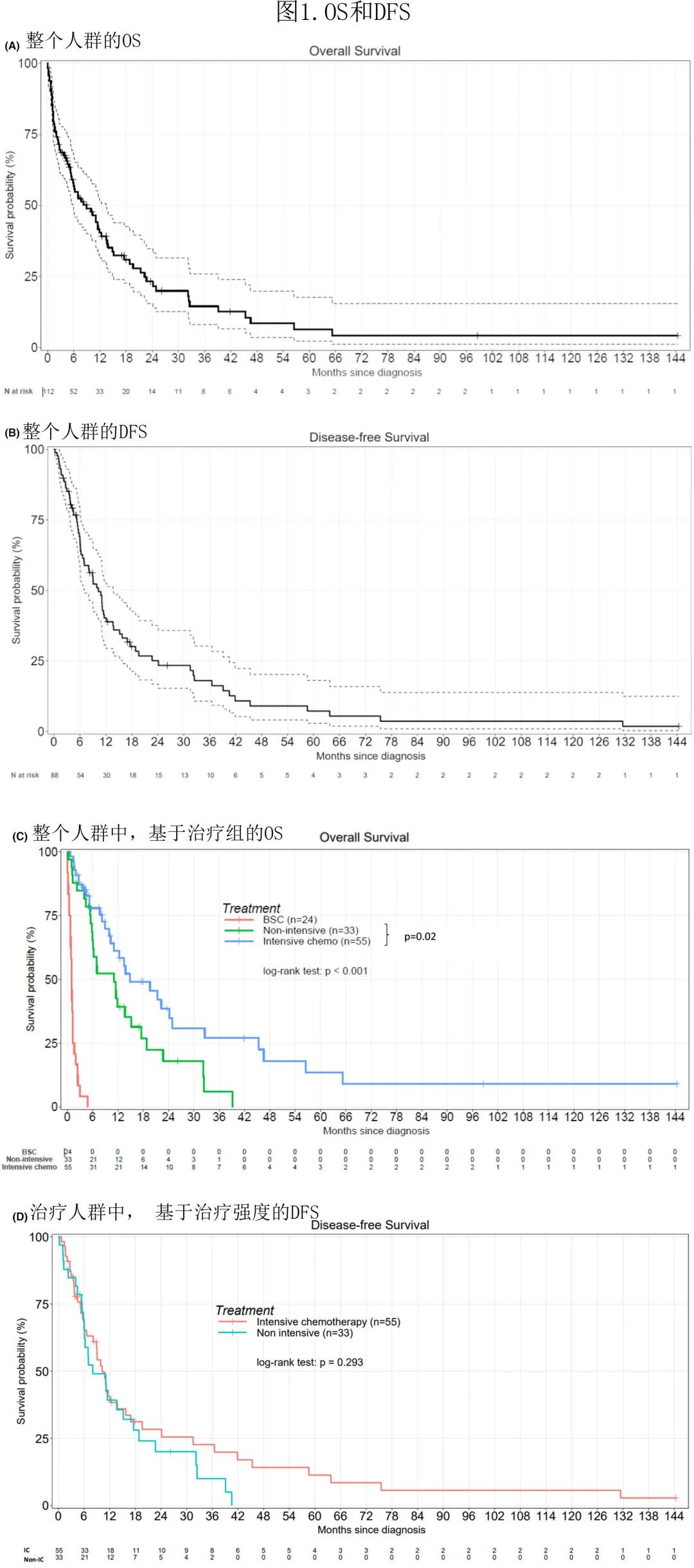
单变量分析显示接受化疗、高 WBC 和高原始细胞计数、不良核型和 2010 ELN有显著影响(表3)。
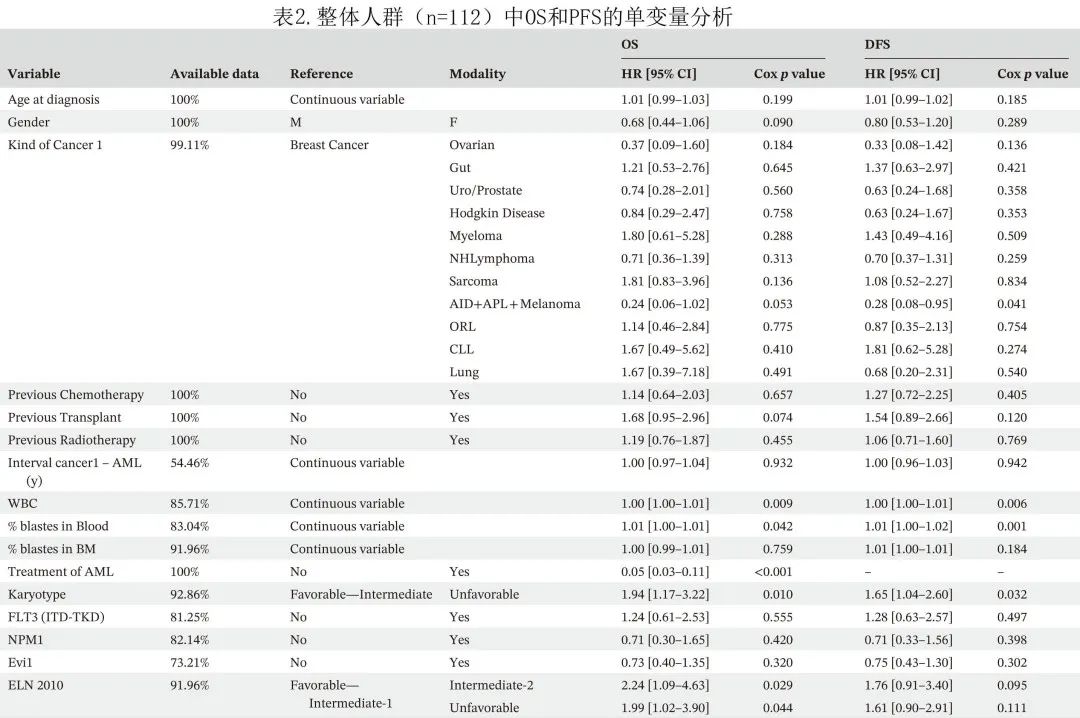
基于2010 ELN 分类的OS(p=0.035) 和DFS(p=0.326) 见图2。
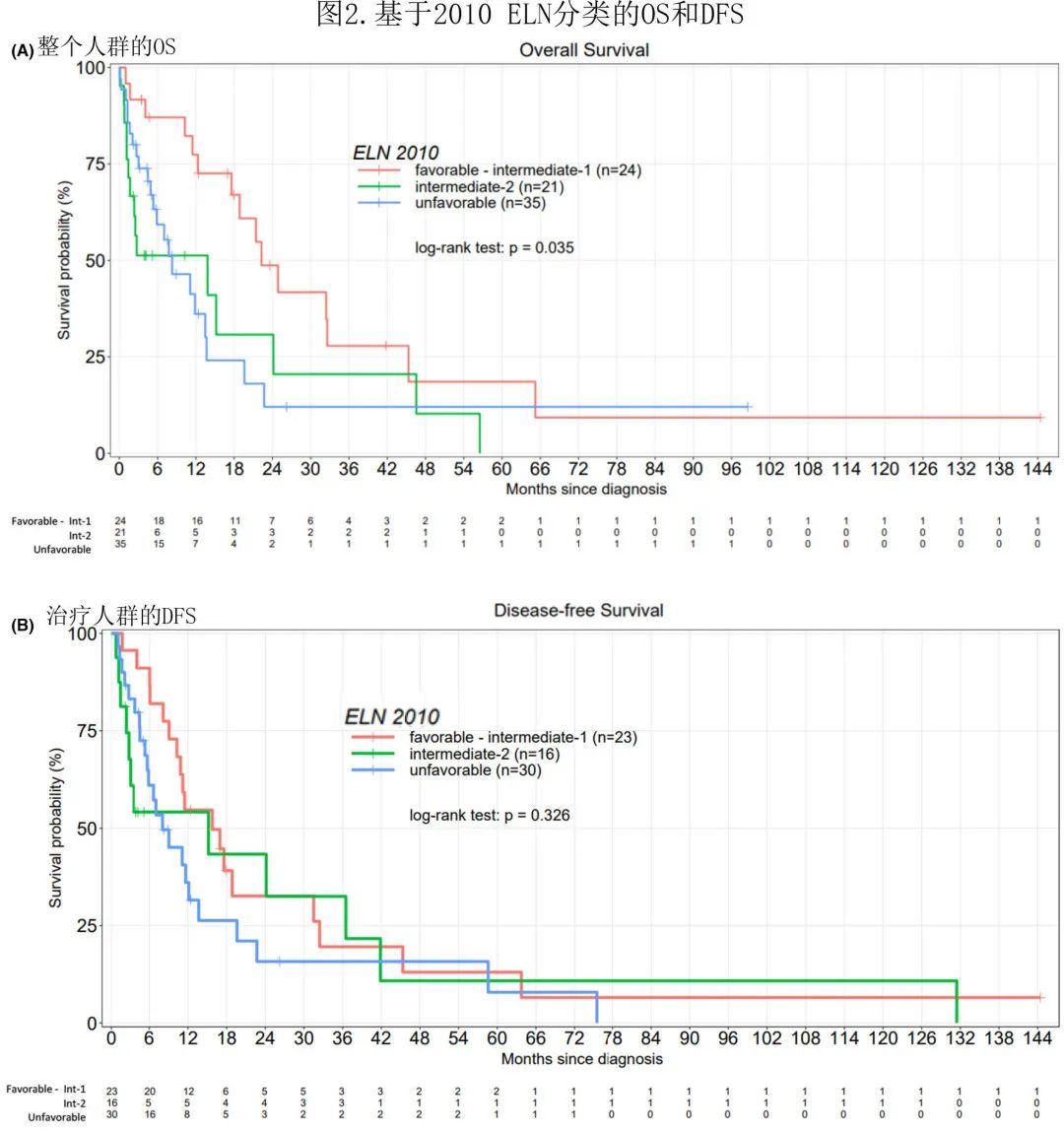
在88例 IC 或非 IC 治疗患者中,43例达到 CR [IC 和非 IC 组分别为39/55(71%) 和4/33(12%)];43例患者中13例在末次随访时存活(9例CR,4例复发),30例死亡 [16例死于复发 (53%),14例死于非复发原因]。其余45例未达到 CR 的患者中,41例 (91%) 死于疾病,4例失访。
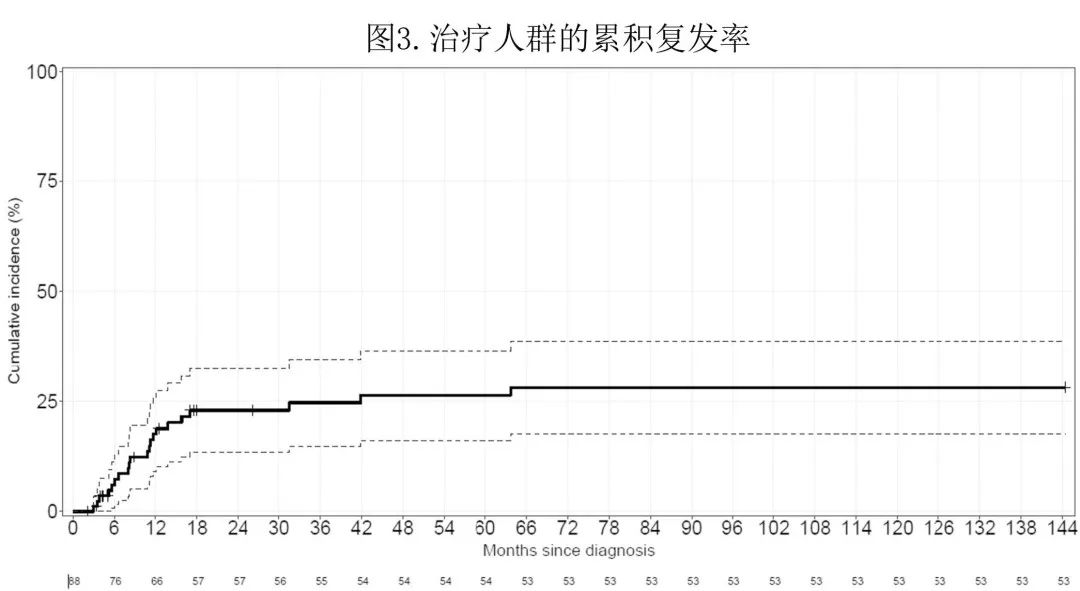
在治疗人群中,中位随访8.2个月,中位 OS 和 DFS 分别为13.5个月 和8.2个月;接受 IC 的患者中位 OS 为14.8个月,中位 DFS 为9.9个月。治疗人群在12、36和60个月时的累积复发率 (CI) 分别为17.5%、24.7%和26.4%(图3)。
在整个队列的多变量分析中(表3A),WBC 计数>4x109/L对 OS 有显著的负面影响 (p=0.02),而接受化疗对 OS 有显著的积极影响 (p<0.001)。

在仅包括治疗患者的多变量分析中(表3B),既往 Auto-HCT 对OS(p=0.028) 和DFS(p=0.045) 有显著负面影响,WBC 计数 >4x109/L对OS(p=0.03) 和DFS(p<0.001) 有显著负面影响,化疗类型(IC vs.非IC)对 OS 有显著负面影响 (p=0.026)。
为了对化疗强度的影响进行无偏倚的估计,对 OS 进行了仅涉及混杂变量(年龄、既往癌症数量、骨髓原始细胞计数和 2010 ELN 分类)的单变量和多变量分析:在单变量中观察到化疗强度的持续显著影响,但在多变量分析中消失。
配对分析的结果
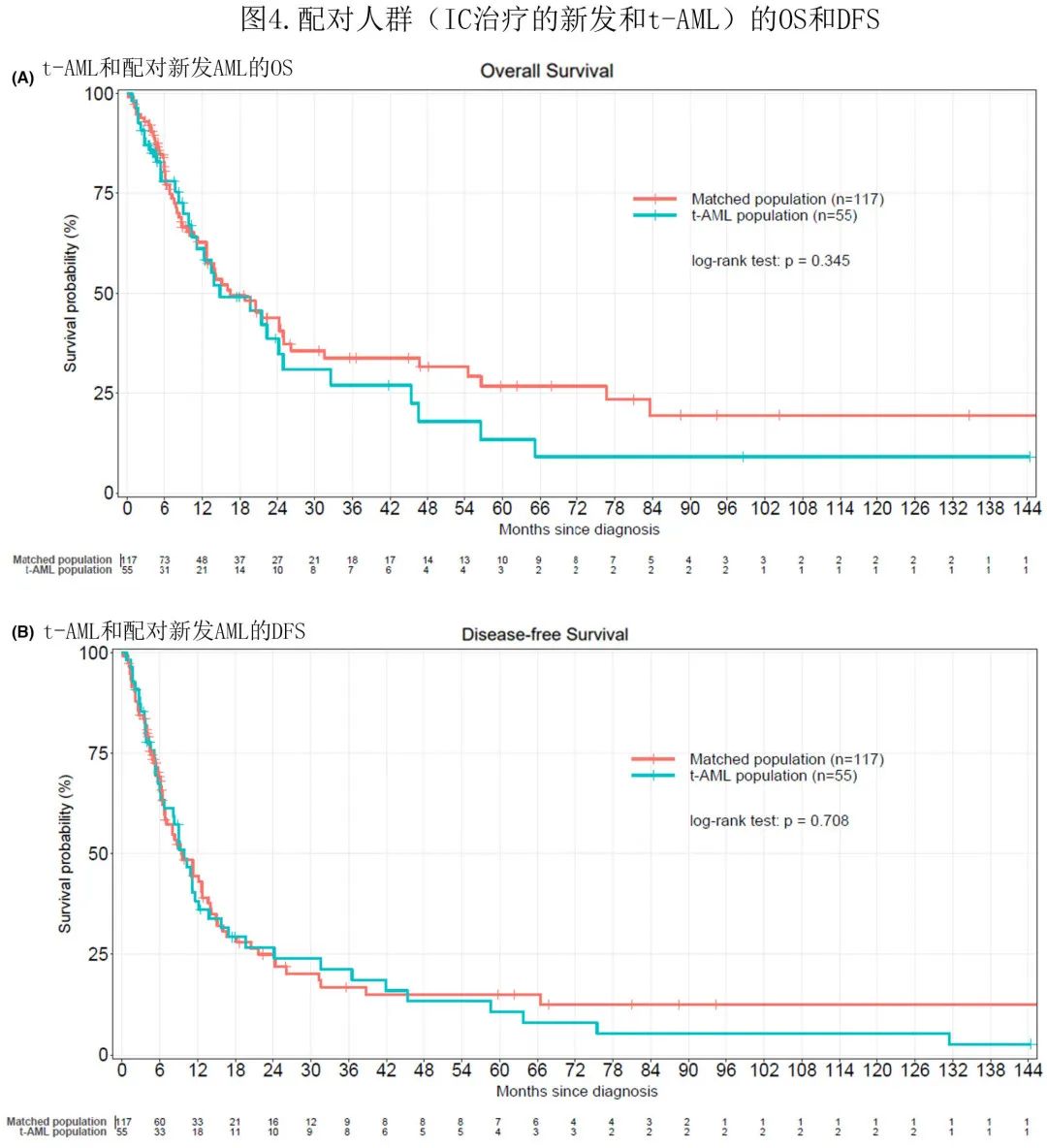
为比较 IC 治疗的新发AML(n=117) 和t-AML(n=55) 的临床结局进行了配对分析。两个匹配队列的特征无显著差异,年龄有差异但未达到显著水平。新发和 t-AML 患者的中位 OS 分别为16.5个月和14.8个月 (p=0.345)。新发和 t-AML 的中位 DFS 分别为9.45个月和9.9个月 (p=0.708)(图4)。
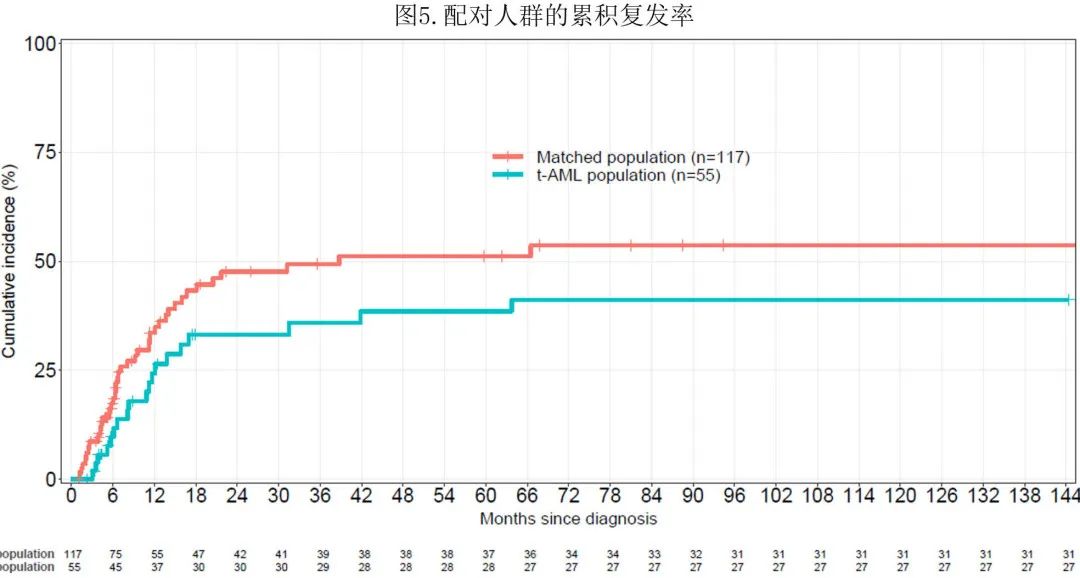
新发和 t-AML 患者2年累积复发率分别为47.6%和33%,5年时分别为51%和38.5%,t-AML累积复发率较低(图5)。
Allo-HCT的结果
15例患者 [5例男性和10例女性,中位年龄53岁]在首次 CR 接受了Allo-HCT。移植前,14例患者接受IC,1例患者接受HMA,无患者接受CPX-351。9例患者接受了清髓性 (MAC)(n=2) 或降低强度预处理 (RIC)(n=13),包括抗胸腺细胞球蛋白 (ATG)。造血细胞来源为2例骨髓、1例脐血单位和11例外周造血细胞,来自6例基因全相合供者、4例无关 HLA 相合供者和4例非亲缘HLA 不相合供者。
移植后,2例患者出现移植物失败,在13例可评估患者中,12例达到完全供体嵌合体,1例达到混合嵌合体。13例患者中的6例发生了急性移植物抗宿主病 (GVHD)(1例 I 级、3例 II 级和2例 III 级),6例发生了慢性GVHD(1例广泛和5例有限)。移植后最佳疗效为 CR 10 例。在末次随访时,4例患者存活(3例CR,1例复发),11例死亡(5例复发,5例移植相关死亡原因,1例后续恶性肿瘤)。
总结
本回顾性研究共纳入112例成人患者。55例患者接受了强化化疗 (IC),33例接受了非IC,24例接受了最佳支持治疗。在 t-AML 诊断时,分别有42%和44%的患者呈现不良核型和高危2010年 ELN 风险特征。在接受治疗的患者 (n=88) 中,43例 (49%) 达到完全缓解:非 IC 组和 IC 组分别为4/33(12%) 和39/55(71%)。中位随访5.5个月,整个人群的中位OS和DFS分别为9个月和6.3个月,88例治疗患者分别为13.5个月和8.2个月。OS 和 DFS 的单变量分析显示诊断时高白细胞和原始细胞计数、不良核型和 ELN 分类具有显著影响。多因素分析显示诊断时 WBC 计数的负面影响和化疗对整个人群 OS 和 DFS 的积极影响。研究还显示,既往自体 HCT 和高 WBC 计数对治疗患者的 OS 和 DFS 以及 IC 对 OS 的负面影响;仅考虑混杂变量(年龄、既往癌症、骨髓原始细胞和 2010 ELN 分类)时,这些影响会消失。在比较 IC 治疗的 t-AML 与新发 AML 的配对匹配分析中,两个人群之间的 OS 和 DFS 没有差异。
具有不良特征的 t-AML 患者几乎占人群的一半。在接受 IC 的患者中获得的最佳结局必须由已知的混杂变量平衡,并应通过使用新的创新药物和治疗策略来改善。
总的来说,t-AML患者的最佳治疗策略需要考虑年龄、体能状态、预后因素,同时整合新的可用治疗。对于老年 t-AML 患者和因合并症不适合 IC 和/或 Allo-HCT 的年轻患者,去甲基化药物或阿糖胞苷与维奈克拉联合或不联合靶向治疗(FLT3、IDH抑制剂或抗 CD47 抗体,尤其是 TP53 突变患者)似乎是最佳治疗选择。对于适合 Allo-HCT 的患者,为了降低毒性并改善移植后的结果,既往CPX-351 为基础的化疗应是首选。最后,最佳支持治疗策略在 t-AML 中的效果非常差,加上有了新的治疗方法,可确保在给予 t-AML 患者最佳支持治疗策略之前,对不合格标准进行详尽的分析。
参考文献
Belhabri A,et al. Clinical outcome of therapy-related acute myeloid leukemia patients. Real-life experience in a University Hospital and a Cancer Center in France.Cancer Med . 2023 Aug 7. doi: 10.1002/cam4.6322.
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言