好文推荐 | 乳脂球表皮生长因子8与阿尔茨海默病的关联
昨天 中风与神经疾病杂志 中风与神经疾病杂志
MFG-E8与AD存在关联,可能通过AD病理标志物影响侧脑室体积变化。
摘要
目的 探讨乳脂球表皮生长因子8(MFG-E8)与阿尔茨海默病(AD)的关联。方法 使用阿尔茨海默病神经影像计划数据库,多元线性回归用来研究MFG-E8与AD病理标志物以及脑结构的关联并进行亚组分析。使用混合效应模型研究MFG-E8与AD病理标志物和脑结构的纵向变化。中介分析用来研究MFG-E8与AD病理和脑结构之间的潜在关联。结果 一共377例纳入研究,MFG-E8水平与脑脊液中β淀粉样蛋白42(Aβ42),tau蛋白以及磷酸化tau蛋白(P-tau)浓度呈正相关,亚组分析结果显示,在男性、老年人以及携带APOE4基因的人群中,MFG-E8水平与AD病理标志物的浓度及侧脑室体积的大小关联与总体人群一致。纵向结果表明,在随访时间内,MFG-E8水平的升高与侧脑室体积扩大显著相关。此外,MFG-E8可通过影响Aβ42水平改变侧脑室体积。结论 MFG-E8与AD存在关联,可能通过AD病理标志物影响侧脑室体积变化。
阿尔茨海默病(Alzheimer disease,AD)是一种神经系统变性疾病,其特征为进行性认知功能下降和大脑中β淀粉样蛋白42(amyloid β-protein 42,Aβ42)和磷酸化tau蛋白(phosphorylated tau protein,P-tau)的异常沉积。近年来,人们开始关注脑脊液(cerebrospinal fluid,CSF)中蛋白质在AD发病机制中的作用,其中乳脂球表皮生长因子8(milk fat globule-epidermal growth factor 8,MFG-E8)作为一个新的焦点引起了研究人员的极大兴趣。MFG-E8是乳汁中的一种蛋白质,但其也在神经系统中的表达。MFG-E8还在炎症调节、细胞凋亡和免疫反应等生物学过程中发挥着重要作用。
近期研究发现MFG-E8与AD病理标志物存在关联。研究人员观察到MFG-E8与Aβ42相互作用,并可以促进Aβ42的聚集;同时,MFG-E8的表达也与AD病理标志物T-tau的沉积过程相关。通过小鼠模型实验发现MFG-E8基因敲除小鼠表现出更严重的认知障碍,加重了脑白质损害和髓鞘微观结构破坏,进一步证实了MFG-E8在AD病程中的关键地位。
此外,MFG-E8与认知功能下降有关。有研究发现AD患者的MFG-E8表达水平较高,并且与认知能力下降密切相关。实验结果表明MFG-E8可以调节小胶质细胞和星形胶质细胞的活性,从而影响突触的形成和稳定,进而影响认知功能。
虽然前述研究揭示了MFG-E8与AD病理标志物之间的关联,但这些研究大多基于动物模型,而关于MFG-E8与认知的研究缺少病理标志物以及脑结构的支持。为了填补这些空白,本研究使用阿尔茨海默病神经影像计划(Alzheimer’s Disease Neuroimaging Initiative,ADNI)数据库,着重探讨MFG-E8与AD病理标志物、认知功能以及脑结构之间的关联,以期能更深入地认识MFG-E8在AD发病机制中的角色,为未来研发针对AD的治疗策略提供更深入的理解。
1 资料与方法
1.1 一般资料
研究数据来自ADNI数据库(http://adni.loni.usc.edu)。ADNI包括临床、成像、遗传和生化生物标志物数据,用于AD的早期检测和跟踪。本研究获得了研究参与者的知情同意和伦理委员会的批准。
1.2 方法
1.2.1 CSF和血浆生物标志物的测量
参与本次研究的受试者需具备可用的基线的CSF Aβ42、P-tau、T-tau、MFG-E8和MRI等相关信息。上述生物标志物和影像学检测的方法及分析已于先前文章中详细描述。宾夕法尼亚大学通过多个Luminex xMAP平台(Luminex Corp,Austin,TX,USA)和INNOBIA AlzBio3试剂盒(Fujirebio,Ghent,Belgium)完成了CSF Aβ42、P-tau和T-tau水平(单位:pg/ml)。所有CSF生物标志物测定重复进行并取平均值。我们额外使用了T-tau/Aβ42和P-tau/Aβ42比值,因为它们可以为精确地体现病理学上的异常情况,并有助于提示认知功能的转变。当这两个比值数值上升时,可能预示着AD的存在,并和认知功能的降低存在密切关联。
1.2.2 MRI评估
影像学数据可通过ADNI数据库获得。MRI T1加权图像经过初始预处理、强度归一化和梯度扩展。在去除非脑组织的过程中,采用混合分水岭/表面变形算法,然后通过自动Talairach变换来提取皮质下白质和深灰质的体积结构。将侧脑室作为感兴趣区域进行后续的分析。
1.2.3 认知评估
简易精神状况检查量表(Mini-Mental State Examination,MMSE)作为一种操作便捷、全面且标准化的认知功能评估工具,被广泛应用于临床和科研领域。它能够方便快捷地评估多项认知功能,因此成为早期发现认知功能障碍和痴呆症状、监测疾病进展、评价治疗效果以及探究认知功能与其他因素之间关系的理想工具。故本研究使用MMSE作为评估认知功能的工具。
1.3 统计学方法
对于连续变量,正态分布与非正态分布分别采用(x±s)或中位数(四分位数间距) [M(P25,P75)]进行描述,并用方差分析或Mann-Whitney U检验进行研究;分类变量则采用数值(n)和百分比(%)进行表示,运用卡方检验比较每组之间差异。在探讨MFG-E8指数与AD病理、认知和脑结构之间的关系时,采用多元线性回归,并根据年龄(<65岁,≥65岁)、性别(男性,女性)、APOE4携带状态(携带APOE4基因,未携带APOE4基因)和认知诊断[认知正常,轻度认知受损(mild cognitive impairment,MCI)]等因素,进行了亚组分析。采用混合效应模型进行研究MFG-E8与AD病理标志物和脑结构之间的纵向关联。
为了确定AD生物标志物是否介导了MFG-E8和侧脑之间的关系,本研究采用了Baron和Kenny推荐的中介分析方法:(1)MFG-E8与脑脊液AD生物标志物存在关联;(2)MFG-E8水平与侧脑室体积存在关联;(3)CSF AD病理标志物浓度与侧脑室体积存在关联;(4)将CSF AD生物标志物作为中介因素引入回归模型后,MFG-E8水平与侧脑室体积之间的关联程度应有所减弱。
所有的分析过程将年龄、性别、教育、APOE4携带状态以及认知诊断等因素作为协变量进行了合理的调整。统计分析均在R 4.2.0版本中执行,所有分析的统计显著性设置为双侧P<0.05,以确保结果的真实性。
2 结 果
2.1 纳入人群基线特征
一共纳入377例,平均年龄为73.10岁。在这些受试者中,女性比例达到43.7%。相较于认知功能正常的参与者,MCI的参与者其MFG-E8,T-tau,P-tau,T-tau/Aβ42以及P-tau/Aβ42的数值较高;而Aβ42的水平偏低(见表1)。
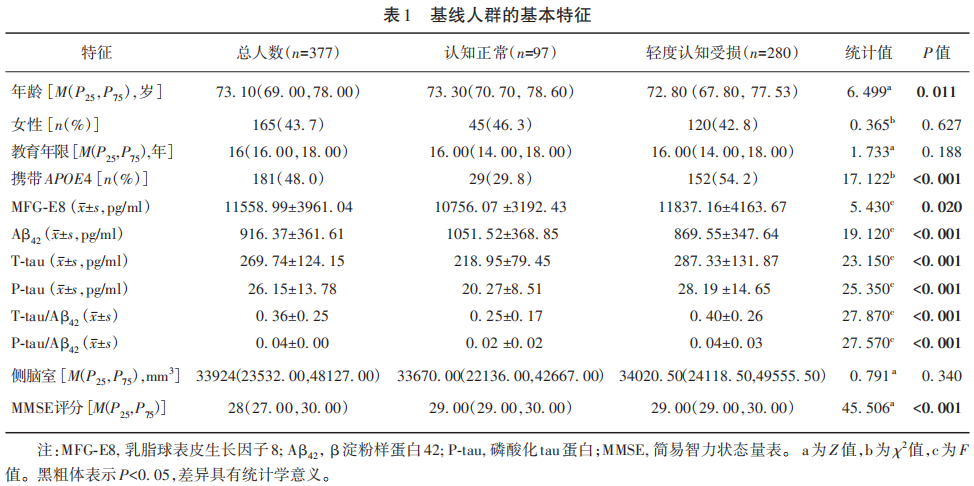
2.2 MFG-E8与AD病理标志物和侧脑室的关联
结果显示,MFG-E8浓度与Aβ42蛋白(β=0.166,P=0.004)、T-tau蛋白(β=0.682,P<0.001)以及P-tau蛋白浓度(β=0.730,P<0.001)呈现明显正相关性;MFG-E8浓度同样也和T-tau/Aβ42(β=0.515,P<0.001)及P-tau/Aβ42(β=0.563,P<0.001)的比值存在正向关系。然而,在脑结构的研究中,MFG-E8水平与侧脑室体积存在负相关性(β=-0.448,P<0.001)(见图1)。
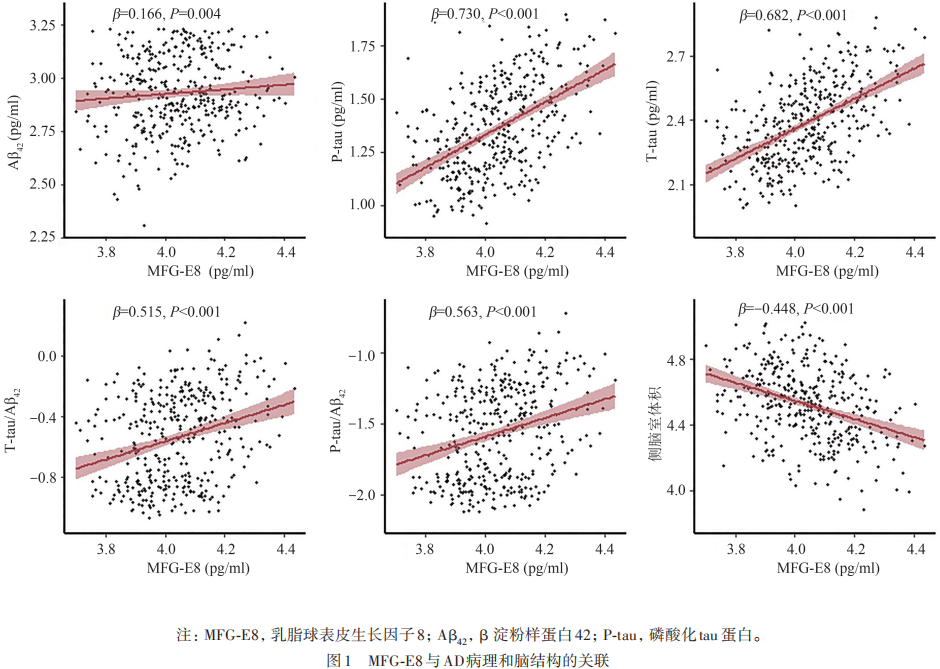
2.3 亚组分析
依据年龄、性别、APOE4基因携带状况以及认知诊断进行亚组分析发现,在65周岁及以上的老年群体中,男性参与者以及APOE4非携带者的参与者中,MFG-E8与AD病理标志物及侧脑室体积之间的相关性更为明显,这与总体人群的结果一致。在认知诊断方面,认知正常组与轻度认知受损组之间未观察到显著差异(见表2)。
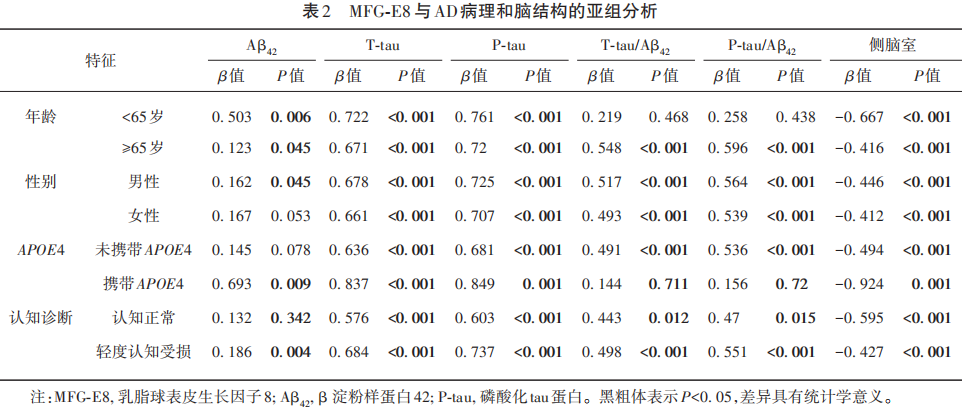
2.4 中介分析
中介分析研究结果揭示,高浓度的MFG-E8与较小的侧脑室体积显著相关。而且, MFG-E8可通过影响CSF Aβ42的浓度进一步影响侧脑室体积。在此过程中,MFG-E8通过Aβ42影响侧脑室体积的效应占总效应的3.99%(见图2)。
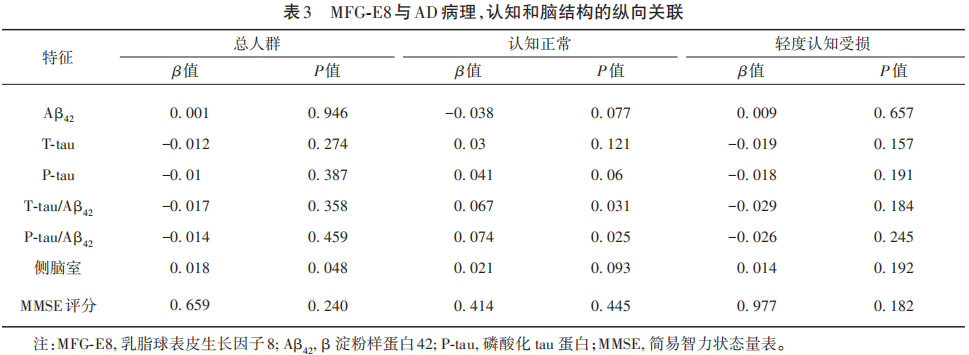
2.5 MFG-E8与AD病理的纵向关联
在总的研究群体中,随时间推移,MFG-E8浓度上升与侧脑室容积的扩大呈现出一定程度的正向关联性(β=0.018,P=0.048),然而,MFG-E8浓度的变化与病理标志物浓度的改变及认知能力的变化并无明显的关联。在认知功能正常的参与者中,MFG-E8浓度的提高与T-tau/Aβ42(β=0.067,P=0.031)和P-tau/Aβ42(β=0.074,P=0.025)比值存在正向关联(见表3)。
3 讨 论
本项研究首次使用人类CSF中的蛋白和AD病理标志物,发现MFG-E8与Aβ42、T-tau蛋白以及P-tau蛋白之间的关联。通过脑影像学分析,发现MFG-E8水平升高与侧脑室体积的增大有关,并且这种关联还可以通过Aβ42蛋白的中介作用实现。同时,长期随访观察的结果显示,随着时间推移,MFG-E8蛋白水平与侧脑室容积成正比。这提示,MFG-E8有可能成为与AD发病机制有关的潜在风险因子。
MFG-E8是一种多功能糖蛋白,由多种细胞表达,包括树突状细胞、小胶质细胞和星形胶质细胞。它与中枢神经系统的多种生理和病理功能有关,包括凋亡细胞的吞噬作用、抗炎和组织再生等。研究发现AD患者的CSF中MFG-E8水平明显升高,这一发现提示MFG-E8可能参与调节AD病理进程。Aβ42的沉积是AD病理学的主要特征之一,而MFG-E8可能与Aβ42的清除和代谢有关。MFG-E8的升高可能反映了AD患者大脑中Aβ代谢的紊乱和沉积的增加,进而加剧了疾病的发展。MFG-E8升高可在AD的早期阶段出现,并随着疾病的进展而进一步增加,这提示MFG-E8水平在AD的不同阶段存在差异。
MFG-E8与炎症反应相关,推测其可能通过引发炎症反应促进炎症因子的分泌影响AD的进展。炎症因子可以直接影响T-tau蛋白的磷酸化状态。在炎症反应中,炎性细胞因子促进T-tau蛋白的异常磷酸化,进而加剧其在神经元内的聚集。炎性介质还可以激活包括丝裂原活化蛋白激酶和磷酸肌醇-3激酶/蛋白激酶B在内的多种信号通路,影响T-tau蛋白的异常磷酸化和聚集。MFG-E8可通过参与这些信号通路的调节,影响T-tau蛋白的异常磷酸化和聚集。
同时,MFG-E8对神经元清除和维护能力可能与脑结构变化有关。研究发现,MFG-E8能够通过调节神经元的凋亡和小胶质细胞的吞噬来影响神经系统的健康状态。在神经系统变性疾病中,神经元的功能通常受到损害,表现为突触失稳、神经递质释放异常等。MFG-E8可能通过影响突触形成和稳定性以及神经递质的合成和释放来调节神经元的功能。MFG-E8在脑缺血发生后可以显著降低炎性细胞因子——白细胞介素-6的表达,还能通过升高BCL2-Associated X的蛋白质/B淋巴细胞瘤-2基因比率来抑制神经元凋亡。在蛛网膜下腔出血的动物模型中,MFG-E8通过降低裂解的胱天蛋白酶3和白细胞介素-1β的表达来减少神经元细胞死亡。
综上,本研究认为MFG-E8与阿尔茨海默病存在关联,并可通过AD病理蛋白影响侧脑室体积的改变。因此,MFG-E8可能是AD治疗的全新突破口。
参考文献
[1]Villemagne VL,Burnham S,Bourgeat P,et al. Amyloid β deposition,neurodegeneration,and cognitive decline in sporadic Alzheimer’s disease:a prospective cohort study[J]. Lancet Neurol,2013,12(4):357-367.
[2]Degenhardt K,Wagner J,Skodras A,et al. Medin aggregation causes cerebrovascular dysfunction in aging wild-type mice[J]. Proc Natl Acad Sci USA,2020,117(38):23925-23931.
[3]Brissette MJ,Lepage S,Lamonde AS,et al. MFG-E8 released by apoptotic endothelial cells triggers anti-inflammatory macrophage reprogramming[J]. PLoS One,2012,7(4):e36368.
[4]Aziz M,Jacob A,Matsuda A,et al. Review:milk fat globule-EGF factor 8 expression,function and plausible signal transduction in resolving inflammation[J]. Apoptosis,2011,16(11):1077-1086.
[5]Wagner J,Degenhardt K,Veit M,et al. Medin co-aggregates with vascular amyloid-β in Alzheimer’s disease[J]. Nature,2022,612(7938):123-131.
[6]Marazuela P,Solé M,Bonaterra-Pastra A,et al. MFG-E8 (LACTADHERIN):a novel marker associated with cerebral amyloid angiopathy[J]. Acta Neuropathol Commun,2021,9(1):154.
[7]Ge X,Li L,Xie C. Medin synergized with vascular amyloid-beta deposits accelerates cognitive decline in Alzheimer’s disease:a potential biomarker[J]. Neural Regen Res,2024,19(7):1414.
[8]Del Campo M,Galimberti D,Elias N,et al. Novel CSF biomarkers to discriminate FTLD and its pathological subtypes[J]. Ann Clin Transl Neurol,2018,5(10):1163-1175.
[9]Ma LZ,Hu H,Wang ZT,et al. P-tau and neurodegeneration mediate the effect of β-amyloid on cognition in non-demented elders[J]. Alzheimers Res Ther,2021,13(1):200.
[10]Petersen RC,Aisen PS,Beckett LA,et al. Alzheimer’s Disease Neuroimaging Initiative (ADNI):clinical characterization[J]. Neurology,2010,74(3):201-209.
[11]Shaw LM,Vanderstichele H,Knapik-Czajka M,et al. Cerebrospinal fluid biomarker signature in Alzheimer’s disease neuroimaging initiative subjects[J]. Ann Neurol,2009,65(4):403-413.
[12]Fagan AM,Roe CM,Xiong C,et al. Cerebrospinal fluid tau/beta-amyloid(42) ratio as a prediction of cognitive decline in nondemented older adults[J]. Arch Neurol,2007,64(3):343-349.
[13]de Jong D,Jansen RWMM,Kremer BPH,et al. Cerebrospinal fluid amyloid beta42/phosphorylated tau ratio discriminates between Alzheimer’s disease and vascular dementia[J]. J Gerontol A Biol Sci Med Sci,2006,61(7):755-758.
[14]Jack CR,Barnes J,Bernstein MA,et al. Magnetic resonance imaging in Alzheimer’s Disease Neuroimaging Initiative 2[J]. Alzheimers Dement,2015,11(7):740-756.
[15]Dodge HH,Zhu J,Harvey D,et al. Biomarker progressions explain higher variability in stage-specific cognitive decline than baseline values in Alzheimer disease[J]. Alzheimers Dement,2014,10(6):690-703.
[16]Gibbons LE,Carle AC,Mackin RS,et al. A composite score for executive functioning,validated in Alzheimer’s Disease Neuroimaging Initiative (ADNI) participants with baseline mild cognitive impairment[J]. Brain Imaging Behav,2012,6(4):517-527.
[17]Baron RM,Kenny DA. The moderator-mediator variable distinction in social psychological research:conceptual,strategic,and statistical considerations[J]. J Pers Soc Psychol,1986,51(6):1173-1182.
[18]Ni YQ,Zhan JK,Liu YS. Roles and mechanisms of MFG-E8 in vascular aging-related diseases[J]. Ageing Res Rev,2020,64:101176.
[19]Hanayama R,Tanaka M,Miyasaka K,et al. Autoimmune disease and impaired uptake of apoptotic cells in MFG-E8-deficient mice[J]. Science,2004,304(5674):1147-1150.
[20]Fuller AD,Van Eldik LJ. MFG-E8 regulates microglial phagocytosis of apoptotic neurons[J]. J Neuroimmune Pharmacol,2008,3(4):246-256.
[21]Hanayama R,Tanaka M,Miwa K,et al. Identification of a factor that links apoptotic cells to phagocytes[J]. Nature,2002,417(6885):182-187.
[22]Vinters HV. Emerging concepts in Alzheimer’s disease[J]. Annu Rev Pathol,2015,10:291-319.
[23]Caldeira C,Cunha C,Vaz AR,et al. Key aging-associated alterations in primary microglia response to beta-amyloid stimulation[J]. Front Aging Neurosci,2017,9:277.
[24]Shadfar S,Hwang CJ,Lim MS,et al. Involvement of inflammation in Alzheimer’s disease pathogenesis and therapeutic potential of anti-inflammatory agents[J]. Arch Pharm Res,2015,38(12):2106-2119.
[25]Gao Y,Tan L,Yu JT,et al. Tau in Alzheimer’s disease:mechanisms and therapeutic strategies[J]. Curr Alzheimer Res,2018,15(3):283-300.
[26]Kitazawa M,Cheng D,Tsukamoto MR,et al. Blocking IL-1 signaling rescues cognition,attenuates tau pathology,and restores neuronal β-catenin pathway function in an Alzheimer’s disease model[J]. J Immunol,2011,187(12):6539-6549.
[27]Merecz-Sadowska A,Sitarek P,Śliwiński T,et al. Anti-inflammatory activity of extracts and pure compounds derived from plants via modulation of signaling pathways,especially PI3K/AKT in macrophages[J]. Int J Mol Sci,2020,21(24):9605.
[28]Moens U,Kostenko S,Sveinbjørnsson B. The role of mitogen-activated protein kinase-activated protein kinases (MAPKAPKs) in inflammation[J]. Genes,2013,4(2):101-133.
[29]Cheyuo C,Aziz M,Wang P. Neurogenesis in neurodegenerative diseases:role of MFG-E8[J]. Front Neurosci,2019,13:569.
[30]Tzioras M,Daniels MJD,Davies C,et al. Human astrocytes and microglia show augmented ingestion of synapses in Alzheimer’s disease via MFG-E8[J]. Cell Rep Med,2023,4(9):101175.
[31]Marttinen M,Kurkinen KM,Soininen H,et al. Synaptic dysfunction and septin protein family members in neurodegenerative diseases[J]. Mol Neurodegener,2015,10:16.
[32]Cheyuo C,Jacob A,Wu R,et al. Recombinant human MFG-E8 attenuates cerebral ischemic injury:its role in anti-inflammation and anti-apoptosis[J]. Neuropharmacology,2012,62(2):890-900.
[33]Liu F,Chen Y,Hu Q,et al. MFGE8/Integrin β3 pathway alleviates apoptosis and inflammation in early brain injury after subarachnoid hemorrhage in rats[J]. Exp Neurol,2015,272:120-127.
作者:中风与神经疾病杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#阿尔茨海默病# #痴呆# #乳脂球表皮生长因子8# #β淀粉样蛋白42#
4