中医科学院重大发现:黄芩汤竟能调控氨基酸平衡,激活抗癌通路,有效预防结肠炎引发的癌症!
2024-10-28 梅斯循证中医药 MedSci原创
该论文评估了HQT在缓解或延缓CAC方面的疗效。
结直肠癌(CRC)是一种高发的癌症类型,而炎症性肠病(IBD),作为CRC发生的关键风险因素,对特定患者群体,尤其是克罗恩病和溃疡性结肠炎患者,构成了更为显著的威胁。由IBD诱发的结肠炎相关结肠直肠癌(CAC)往往于病程晚期方得确诊,致使患者的五年生存率低至19%,这一数据颇为堪忧。鉴于此,深入剖析结肠炎向癌症演变的机制,并采取早期干预措施,显得尤为重要。
黄芩汤(HQT)是治疗胃肠道疾病的经典方剂,其效用备受认可。现代药理学研究表明,该方剂包括抗炎、镇痛及免疫调节等药理特性。有研究揭示,HQT对CAC具有良好的治疗效果,能够有效缓解CAC症状,并抑制肿瘤的发展进程。然而,关于HQT在结肠炎向癌症转化过程中所发挥的具体作用机制,目前尚未得到明确阐述。
日前,一篇名为“Huangqin tang alleviates colitis-associated colorectal cancer via amino acids homeostasisand PI3K/AKT/mtor pathway modulation”的论文评估了HQT在缓解或延缓CAC方面的疗效。

图1 论文首页
HQT缓解AOM/DSS诱导的小鼠CAC
研究显示,AOM/DSS诱导的CAC小鼠在初期阶段展现出严重的结肠炎症状,具体包括腹泻、行为冷漠、嗜睡、食欲下降及体重减轻等。随后,这些小鼠逐渐出现脓血便,这标志着多发性结肠肿瘤的发展。在长时间应用HQT后,前述症状得到显著改善。相比之下,模型组小鼠的症状并未出现明显改善。在10周的观测期结束后,与对照组(NC)相比,模型小鼠的体重增长幅度较低。尽管体重变化未达显著水平(图2B),但HQT显著抑制了CAC小鼠结肠长度的异常增加(图2C)。研究中,AOM/DSS的肿瘤诱导效率达到了100%。经HQT处理后,肿瘤总数显著降低。此外,HQT还显著减少了结肠中腺瘤及微腺瘤的总数(图2D)。与NC组相比,模型组小鼠的胸腺重量减轻,而脾和肺的重量则分别有所增加。经HQT处理后,模型小鼠的脾和肺重量降低至低于原始记录的水平,同时胸腺重量有所增加(图2E)。
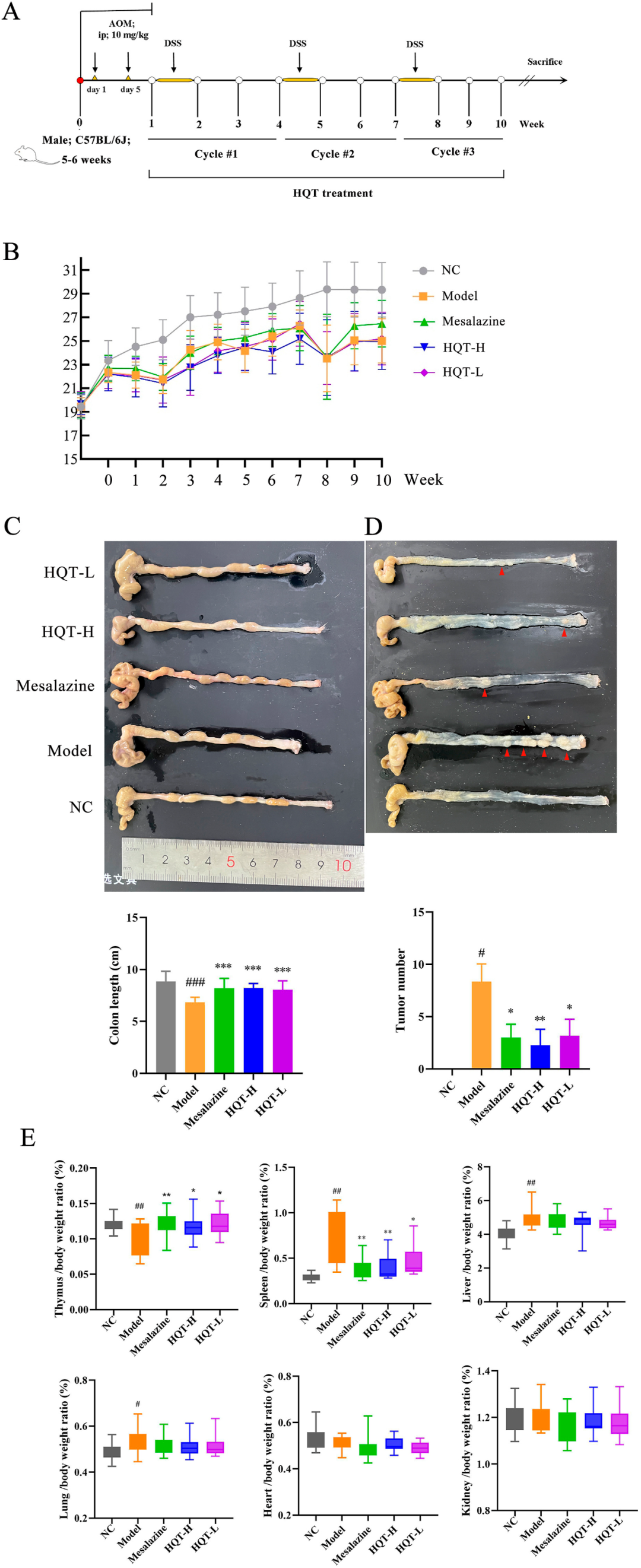
图2 HQT缓解了AOM/DSS诱导的小鼠CAC
依据CAC进程的“炎症-增殖-癌变”模型,研究对生化指标进行了监测,并对前述三个病理阶段的组织切片实施了深入分析。相较于NC组,白细胞介素-6(IL-6)、IL-1β以及肿瘤坏死因子-α(TNF-α)在全部三个阶段均呈现出显著上升的趋势。而IL-4与IL-10则仅在炎症初期阶段出现显著下调。值得注意的是,HQT有效逆转了由AOM/DSS诱导的上述细胞因子变化,具体表现为IL-6、IL-1β及TNF-α浓度的下降。与NC组相比,CAC肿瘤形成阶段中,CA199的表达量显著增加,这进一步证实了模型小鼠体内肿瘤的存在(图3A)。此外,流式细胞术检测显示,CAC小鼠的CD4+/CD8+细胞比率偏低(图3B),这提示了免疫功能的缺陷,HQT处理后,CD4+/CD8+免疫指标的这一较低比率得到了提升。
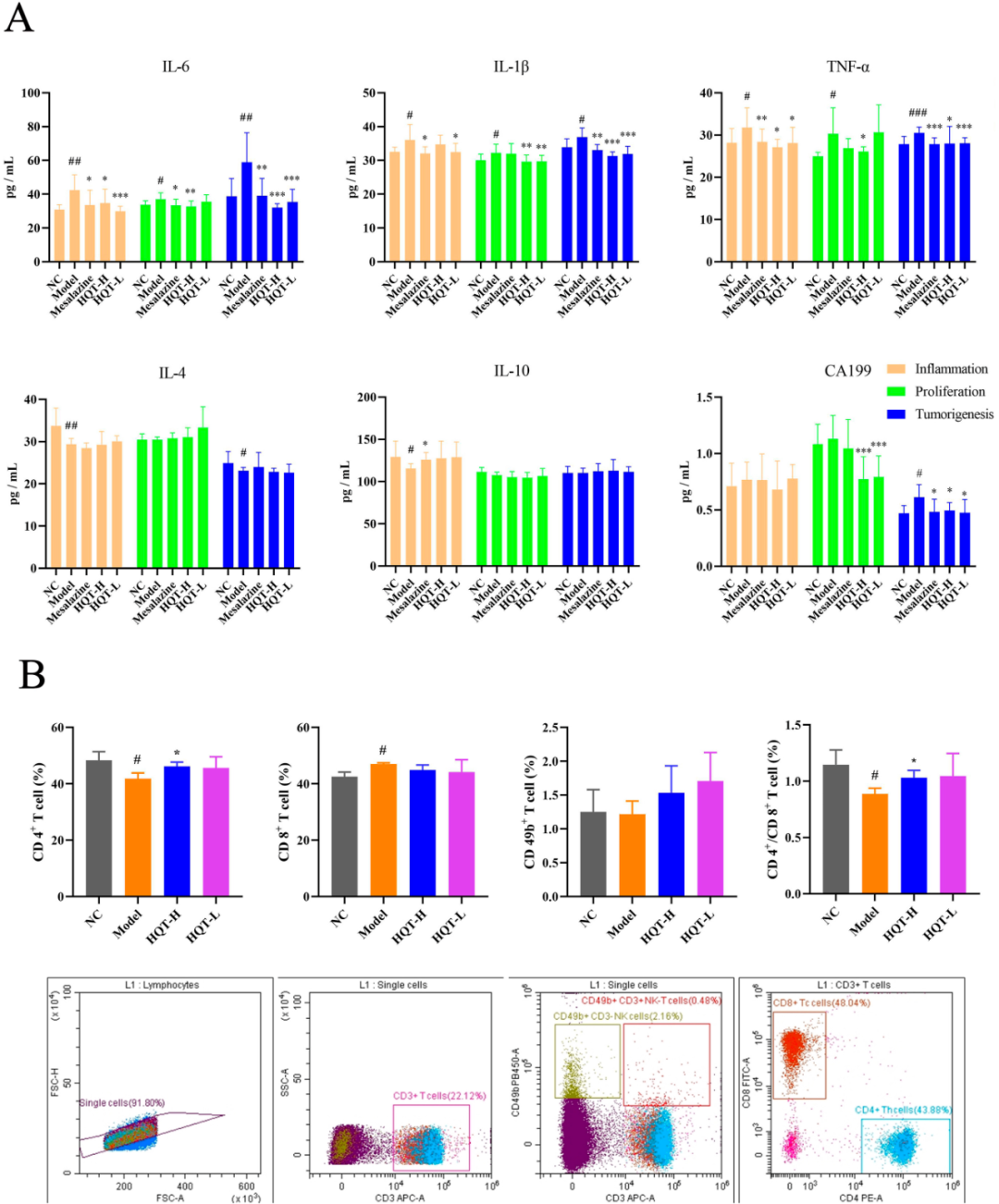
图3 HQT减轻了AOM/DSS在CAC小鼠中诱导的炎症反应和免疫紊乱
HE染色结果显示,相较于NC组,模型组在炎症诱导阶段呈现出显著的炎症细胞浸润现象。随着疾病逐步发展到增殖起始及肿瘤发生阶段,可见肌肉层明显增厚,黏膜层细胞发生异常增殖,并最终演变为晚期上皮内肿瘤的高度病变。在此过程中,HQT有效地遏制了炎症反应、异常细胞增殖及肿瘤的形成(图4A)。此外,增殖标志物Ki67及Tunel染色分析进一步揭示,炎症期,模型小鼠的结肠组织表现出微弱的增殖活性与显著的细胞凋亡现象,而HQT组则显著抑制了细胞凋亡的发生。进入增殖起始与肿瘤发生阶段后,模型组的Ki67组织评分显著高于NC组,Tunel组织评分亦呈现出类似趋势。随着疾病的持续进展,这些细胞沿结肠隐窝长度过度增殖并异常分布,同时模型小鼠的细胞凋亡现象逐渐减少。而HQT则有效地逆转了这一趋势,具体表现为HQT组的Ki67组织评分显著高于模型组(图4B),同时凋亡标志物的组织评分得到显著改善(图4C),这充分表明HQT能够促进结直肠肿瘤组织由增殖状态向凋亡状态的转变。
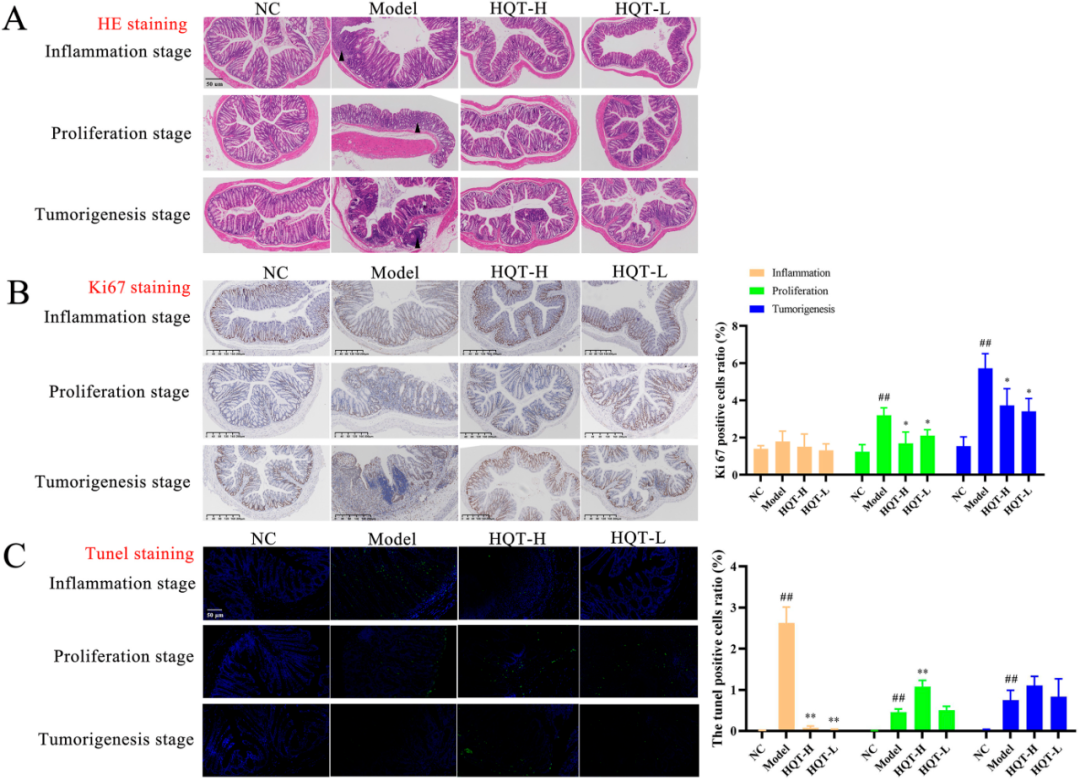
图4 HQT在AOM/DSS模型中抑制结肠肿瘤的进展
HQT在AOM/DSS小鼠中恢复了AAs稳态,特别是在增殖起始和肿瘤发生阶段
肿瘤细胞的异常增殖与AA能量供应之间存在着紧密的关联性。鉴于此,研究实施了针对AA代谢组学的分析,进一步监测了炎症诱导、增殖起始以及肿瘤发生这三个不同阶段中AA水平的变化情况。在炎症诱导阶段,观察发现接近一半的AA呈现出显著的下降趋势,而剩余一定比例的AA则在模型组中呈现出上调态势,这揭示了AA代谢重编程的激活状态。在HQT介入后,仅有少数AA,诸如谷氨酸和异亮氨酸,出现了显著的增加。当进入增殖起始及肿瘤发生阶段时,超过三分之二的AA水平呈现出上升的趋势。与此同时,HQT有效地降低了包括谷氨酸、谷氨酰胺、精氨酸、异亮氨酸、5-oxo-脯氨酸、赖氨酸、丝氨酸和蛋氨酸在内的几种氨基酸的水平(图5)。综上所述,这些数据有力地支撑了HQT能够改善AAs积累,并在CAC疾病发展的整个进程中起到调节AAs代谢稳态作用的观点。
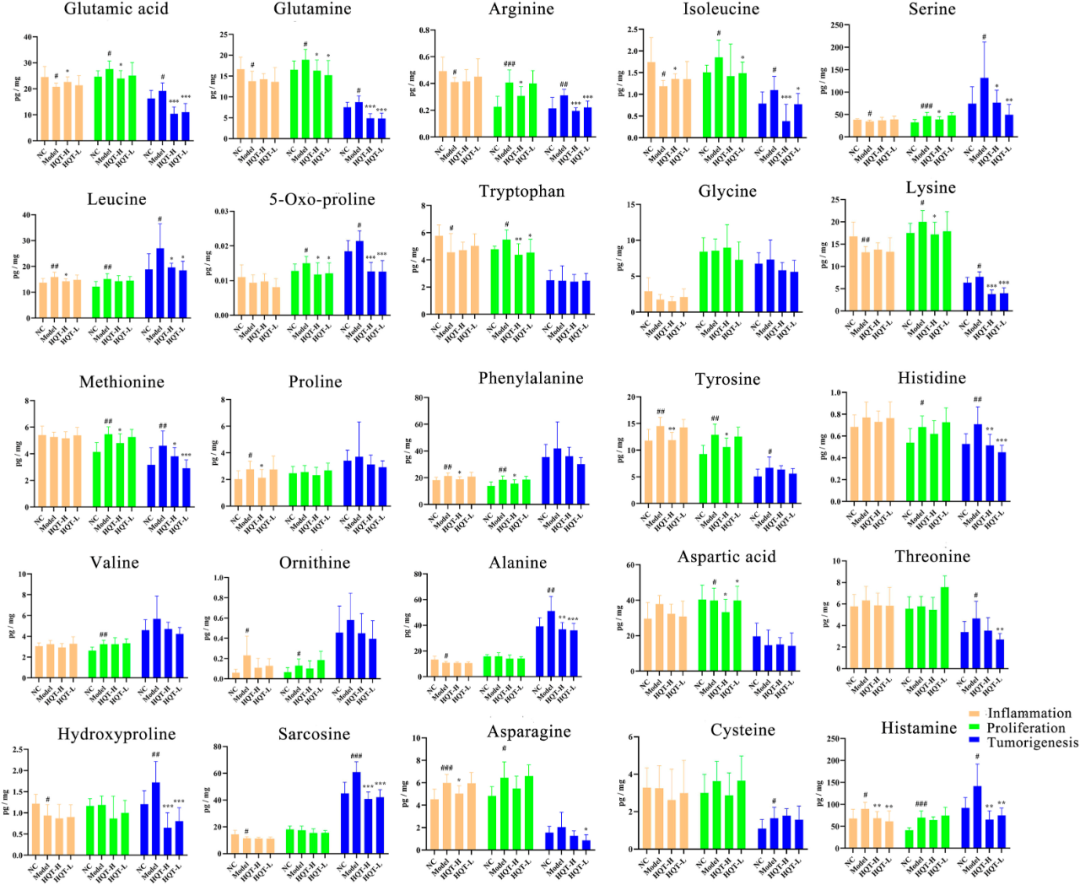
图5 HQT在炎症形成、增殖起始和肿瘤发生三个阶段对特定氨基酸的调节
HQT通过抑制PI3K/AKT通路发挥抗肿瘤作用
鉴于HQT在炎症诱导阶段具有抑制细胞凋亡的作用,而在增殖起始及肿瘤发生阶段则转变为促进细胞凋亡,研究通过蛋白质印迹技术检测了这三个阶段PI3K/AKT/mTOR通路中核心蛋白的表达情况。在炎症诱导阶段,PI3K/AKT/mTOR通路呈现出抑制态势,模型组中促增殖激活因子mTOR及其效应蛋白CDK2的水平显著下降。与此同时,HQT上调了CDKs蛋白的表达(图6A)。进入增殖起始与肿瘤发生阶段,PI3K/AKT/mTOR通路均被激活。在模型小鼠体内,磷酸化PI3K(p-PI3K)、p-AKT及mTOR的表达水平显著上升。与模型组相比,HQT组的p-PI3K与p-AKT表达降低。此外,HQT组中促增殖激活因子mTOR及其效应蛋白CCND1、CDK2和CDK4的水平也显著降低(图6B、C)。结果表明,HQT通过抑制PI3K/AKT通路,进而抑制结直肠肿瘤细胞的增殖并促进其凋亡,从而发挥其抗癌作用。
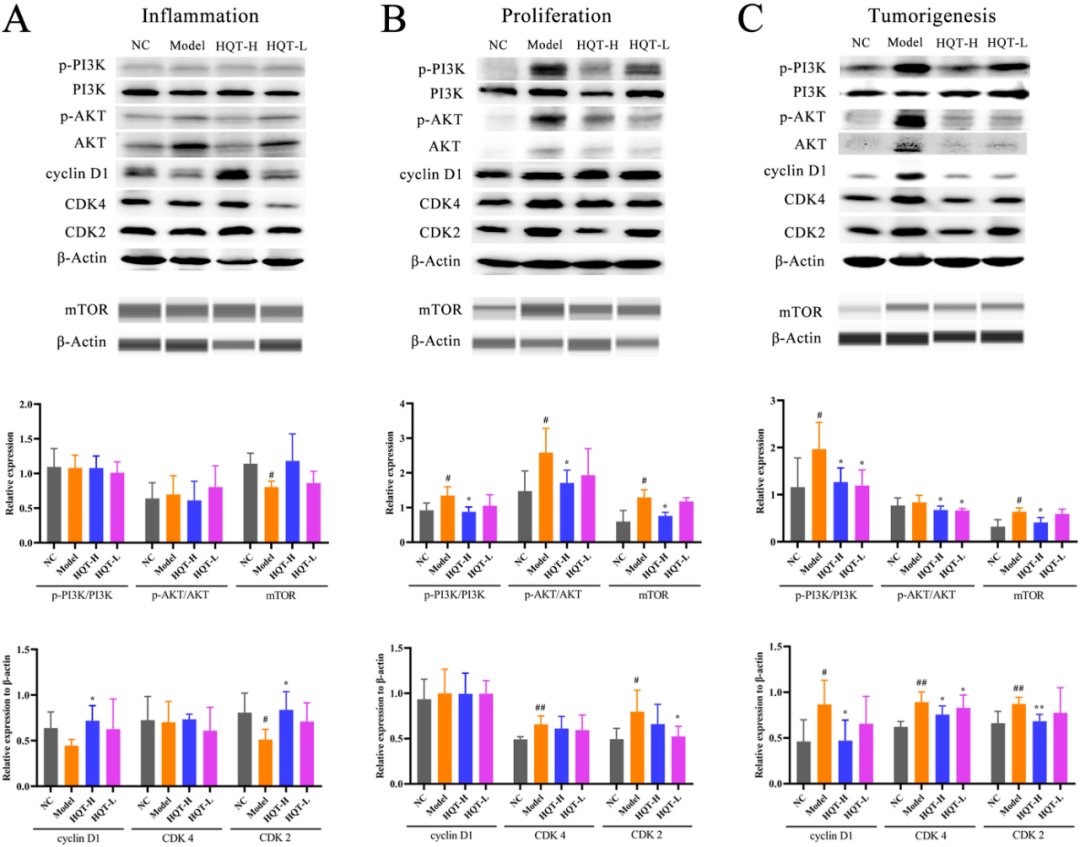
图6 HQT通过抑制PI3K/Akt信号通路抑制肿瘤生长
结论
综上所述,HQT不仅能够有效减轻炎症诱导阶段的炎症反应,并减少由此引发的凋亡损伤,而且还能够抑制增殖起始和肿瘤发生阶段AAs的生成及其下游PI3K/AKT/mTOR通路的激活,进而遏制上皮细胞的异常增殖,并促进其凋亡。
参考文献:
Wang D, Zhu L, Liu H, Feng X, Zhang C, Li T, Liu B, Liu L, Sun J, Chang H, Chen S, Guo S, Yang W. Huangqin tang alleviates colitis-associated colorectal cancer via amino acids homeostasisand PI3K/AKT/mtor pathway modulation. J Ethnopharmacol. 2024 Nov 15;334:118597. doi: 10.1016/j.jep.2024.118597
作者:梅斯循证中医药
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









增殖标志物Ki67及Tunel染色分析进一步揭示,炎症期,模型小鼠的结肠组织表现出微弱的增殖活性与显著的细胞凋亡现象,而HQT组则显著抑制了细胞凋亡的发生。
6
#结直肠癌# #黄芩汤#
8