张锋新论文:通过CRISPR激活筛选,发现癌症免疫治疗耐药性关键蛋白
2022-03-30 生物世界 生物世界
研究结果表明,BCL-2和B3GNT2是癌细胞对细胞毒性T细胞产生耐药性的关键驱动因子。
当前,免疫疗法的兴起显著改变了癌症治疗格局。癌症免疫疗法通过利用免疫系统中的细胞毒性T细胞来消灭癌细胞,并取得了令人欣喜的临床成功。然而,免疫治疗耐药性是该疗法的主要挑战,阐明耐药性产生的具体机制对于免疫治疗的应用至关重要。
近日,张锋教授团队在 Nature Communications 期刊发表了题为:CRISPR activation screen identifies BCL-2 proteins and B3GNT2 as drivers of cancer resistance to T cell-mediated cytotoxicity 的研究论文。
该研究通过CRISPR激活筛选(CRISPRa Screen)发现BCL-2和B3GNT2是癌细胞对细胞毒性T细胞产生耐药性的关键驱动因子,抑制这两个蛋白可以增强肿瘤组织对免疫疗法的敏感性。
这一结果表明,CRISPR激活筛选系统有助于阐明耐药途径并确定癌症免疫治疗的潜在靶标。

相信读者对CRISPR-Cas9基因编辑系统并不陌生,其工作原理也十分简单:Cas9蛋白在gRNA的引导下到靶标基因处进行基因编辑。作为其衍生物,CRISPR激活系统原理也是类似的,唯一不同的是其效应蛋白为突变失活并携带激活因子的dCas9融合蛋白。因此,CRISPR激活系统可以识别特定的基因位点并激活下游基因的表达。
近年来,大量的研究使用CRISPR-Cas9基因编辑系统进行的大规模功能缺失基因筛查发现了许多导致免疫耐药性的关键基因,但也达到了该系统的筛选极限——后续的研究甚至筛选出与之前研究几乎相同的候选基因。
相比之下,CRISPR激活筛选是一个新兴的研究领域,并且具有比CRISPR-Cas9基因编辑系统更大的筛选范围。因此,富集那些上调后产生耐药性的基因,并进行后续的下调功能验证,就可以找到更多导致免疫耐药性的候选基因。
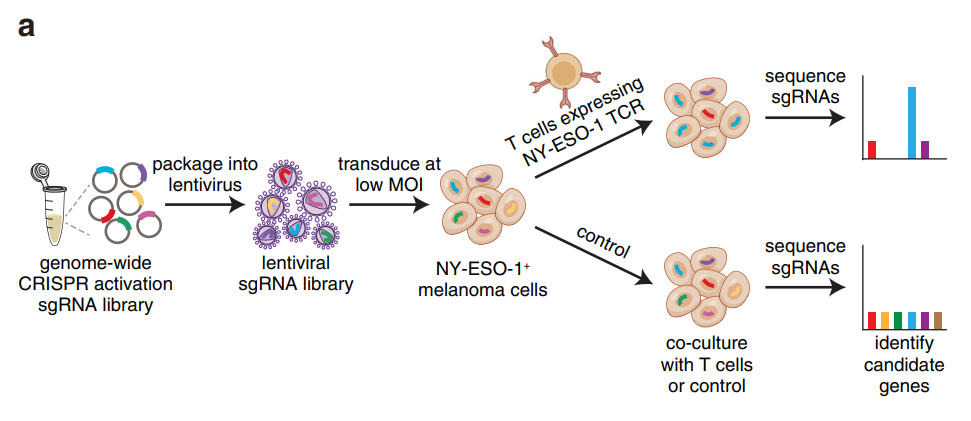
基因组规模的CRISPR激活筛选确定了对T细胞细胞毒性抗性的候选基因
在这项最新研究中,张锋团队进行了全基因组规模的CRISPR激活筛选,以此找寻癌细胞对细胞毒性T细胞产生耐药性的关键驱动因子。研究人员筛选鉴定了4个候选基因——CD274(PD-L1)、MCL1、JUNB和B3GNT2。这些基因在上调后,可以使人类黑色素瘤细胞逃避T细胞的杀伤。
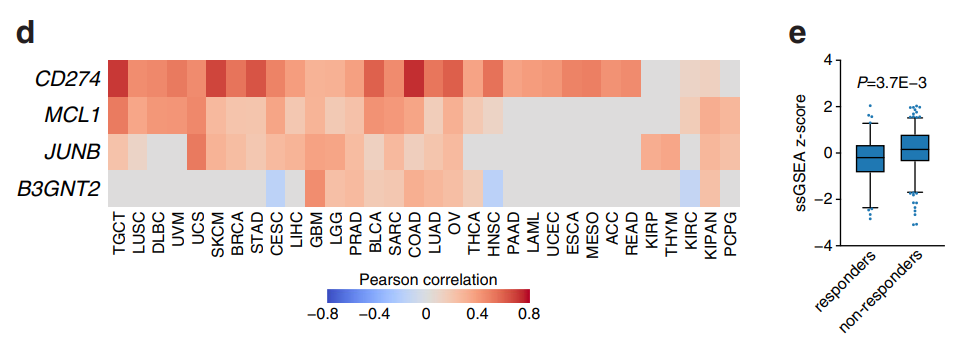
CRISPR激活筛选获得4个对T细胞细胞毒性抗性的候选基因
研究团队进一步探究了这些候选基因的作用机制。他们发现,MCL1和JUNB通过调节线粒体凋亡途径促进免疫耐药:JUNB编码一个转录因子,下调FasL和TRAIL受体,上调MCL1相关BCL2A1,进而激活NF-κB通路,该通路与线粒体凋亡密切相关。
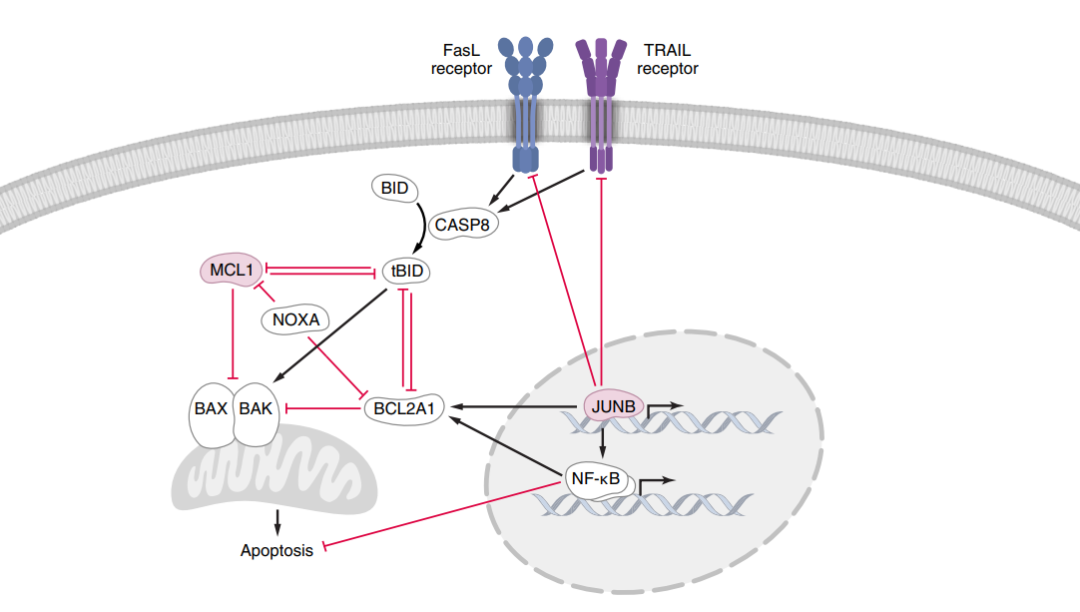
MCL1和JUNB通过线粒体凋亡途径介导对FasL和TRAIL诱导的细胞死亡的抗性
至于B3GNT2,则编码一个多聚N -乙酰氨基合酶,它以正交途径作用超过10个配体和受体,从而干扰肿瘤和T细胞之间的相互作用,导致T细胞激活减少,由此诱导癌细胞的免疫治疗耐药。
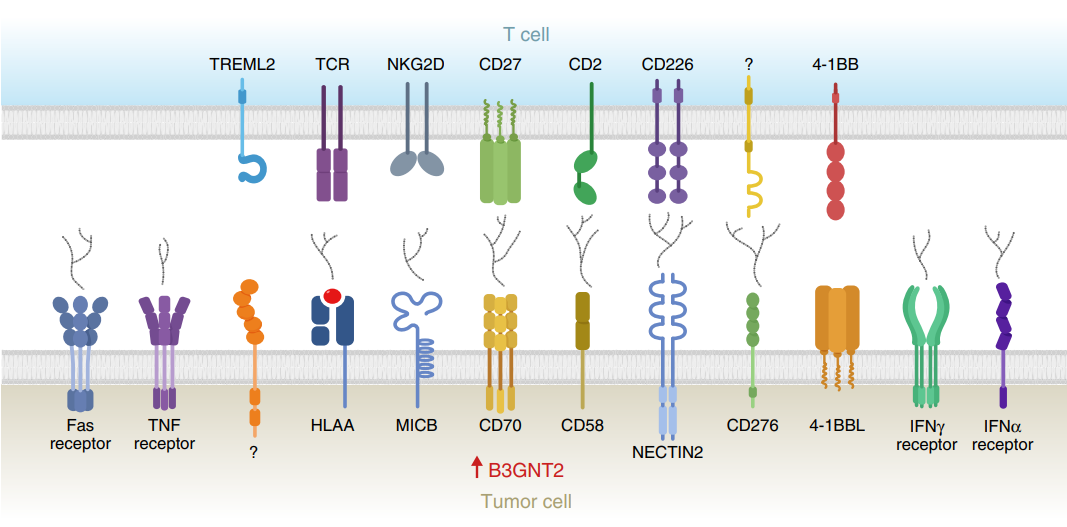
B3GNT2破坏肿瘤和T细胞之间的配体-受体相互作用
不仅如此,在小鼠肿瘤模型中,研究团队证实,过表达这些候选基因使得荷瘤小鼠对免疫治疗的耐药性增强,而与之相对,抑制这些候选基因将使得荷瘤小鼠对免疫治疗更敏感。由此证明这些候选基因促进了免疫治疗耐药性的产生。
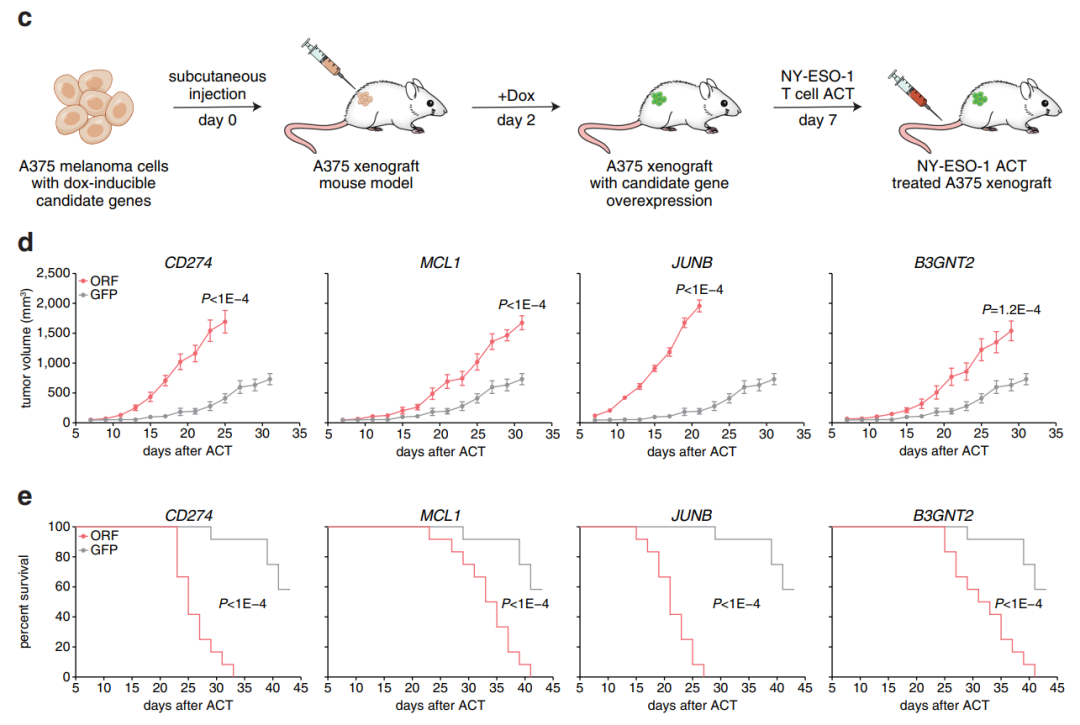
抑制这些候选基因将使得荷瘤小鼠对免疫治疗更敏感
总而言之,上述研究结果表明,BCL-2和B3GNT2是癌细胞对细胞毒性T细胞产生耐药性的关键驱动因子。更重要的是,张锋团队也通过这项研究证实了使用CRISPR激活筛选系统阐明耐药性途径和识别潜在的治疗靶点以扩大癌症免疫治疗的有效性是可行的,并且在未来将会有更广阔的应用前景。
论文链接:
https://www.nature.com/articles/s41467-022-29205-8
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#关键蛋白#
78
#CRISPR#
108
#筛选#
98
太牛了🐂
82
认真学习~~
85