医科院基础所张卫奇/许海燕ACS Materials Lett.封面:岩藻多糖载药纳米凝胶联合放疗增强P-选择素靶向治疗乳腺癌
2023-10-04 BioMed科技 BioMed科技
研究表明,肿瘤局部的电离辐射(放疗)可上调P-选择素在肿瘤细胞和内皮细胞中的表达,这为基于P-选择素靶向的纳米药物递送提供了一种新的选择。
靶向递送抗肿瘤药物可有效提高肿瘤治疗效果,同时降低不良反应。目前,肿瘤特异性受体作为指导药物递送的靶标选择仍非常有限。因此,利用肿瘤新生抗原(Neoantigen,例如,肿瘤组织中新出现或过表达的受体)以区分肿瘤细胞与正常细胞,引导纳米药物靶向递送至肿瘤部位,对于增强纳米药物的抑瘤效应和生物安全性具有重要意义。研究表明,肿瘤局部的电离辐射(放疗)可上调P-选择素在肿瘤细胞和内皮细胞中的表达,这为基于P-选择素靶向的纳米药物递送提供了一种新的选择。
中国医学科学院基础医学研究所张卫奇团队与许海燕团队合作,构建了一种新的自组装多糖纳米凝胶用于P-选择素靶向的肿瘤药物共递送。该团队直接将化疗药物顺铂(Cisplatin, Cis)、米托蒽醌(Mitoxantrone, Mito)与天然多糖岩藻多糖(Fucoidan, Fuc)共组装,制备了呈“蠕虫”状的载药纳米凝胶(FCM)(图1)。研究结果表明,双药共载的FCM纳米凝胶其结构稳定,同时具有良好的药物缓释效应,且保持了Fuc固有的P-选择素靶向能力。通过对FCM的体内和体外治疗效果进行系统评估,研究发现放疗在体内外均可显著上调4T1小鼠乳腺癌模型中P-选择素的表达水平,进而增强FCM针对肿瘤部位P-选择素的靶向递送。与单纯放疗和游离Cis+Mito治疗相比,通过放疗预处理,肿瘤P-选择素表达得到提升,FCM在肿瘤部位具有更好的富集,展现出更佳的抗肿瘤效应。FCM纳米凝胶中主要基质为Fuc,具有生物安全性好的特点。该工作表明FCM可提高小鼠对Cis和Mito两种化疗药的最大耐受剂量。同时,与单独给药游离Cis+Mito相比,FCM可以显著降低药物的系统毒性。
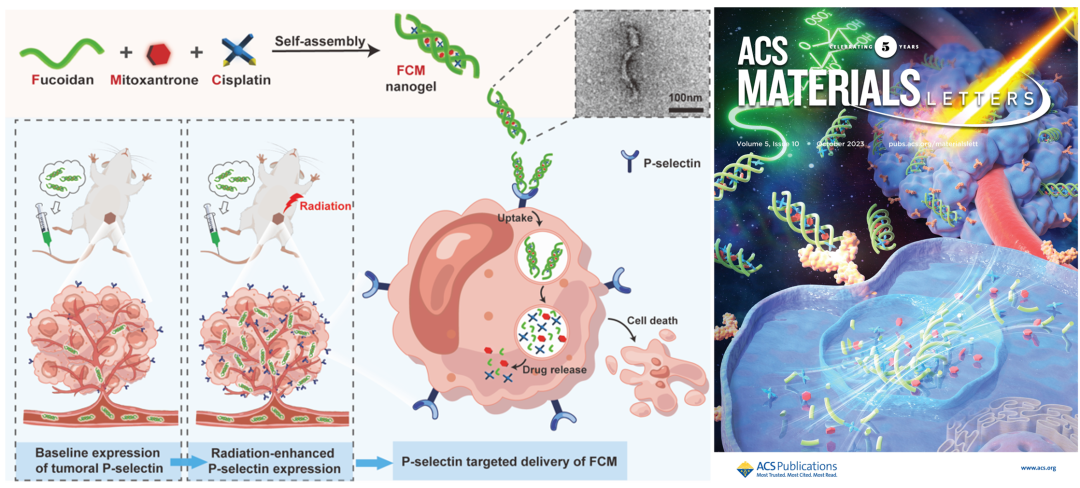
图1. FCM纳米凝胶的制备及作用机制和封面图片。
近期,该工作以“Radiotherapy potentiates the P-selectin targeted cancer drug delivery based on a cisplatin and mitoxantrone co-assembled fucoidan nanogel”为题发表于ACS Materials Letters期刊,并被选为Cover Story。本研究中构建的FCM纳米凝胶通过联合放疗,为治疗P-选择素表达水平低的肿瘤提供了新的治疗策略,同时其制备方法具有简便和低成本的特点,具有良好的生物相容性和转化应用的可行性。
原文链接:
https://pubs.acs.org/doi/10.1021/acsmaterialslett.3c00747
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言