Nature Biotechnology:深度视觉蛋白质组学:对单个癌细胞空间表征,发现癌症治疗新靶点
2022-05-26 nagashi “生物世界”公众号
尽管基于成像和基于质谱的空间蛋白质组学方法取得了许多进展,但将成像与单细胞分辨率蛋白质丰度测量联系起来仍然是一个挑战。
蛋白质是构成生物体的主要成分,同时也是生命活动的主要承担者,研究蛋白质的结构、功能和分布将为疾病致病机理发现、癌症的早期诊断及新型标志物研发提供了准确全面的信息,为人类的疾病治疗策略、药物开发等提供新方案。
然而,尽管基于成像和基于质谱的空间蛋白质组学方法取得了许多进展,但将成像与单细胞分辨率蛋白质丰度测量联系起来仍然是一个挑战。
近日,哥本哈根大学领导的研究团队在 Nature Biotechnology 期刊发表了题为:Deep Visual Proteomics defines single-cell identity and heterogeneity 的研究论文。
该研究开发了一种名为“深度视觉蛋白质组学”(Deep Visual Proteomics,DVP)的新方法。该方法结合了先进的显微技术、人工智能和超高灵敏度蛋白质组学来表征单个肿瘤细胞的特性,可以无偏倚地量化肿瘤细胞中的数千种蛋白质,以此揭示驱动肿瘤进化的机制以及肿瘤的全新治疗靶点。

深度视觉蛋白质组学(DVP),是一种将人工智能驱动的细胞表型图像分析与自动化的单细胞或单核激光显微解剖以及超高灵敏度质谱相结合的新技术。
具体而言,DVP 技术将四种不同技术进步结合到一个工作流程中:首先,先进的显微技术可以生成高分辨率的组织图;其次,在激光显微切割和单细胞采集之前,使用机器学习算法对细胞进行精确分类。然后用质谱分析特定类型的正常或患病细胞,绘制蛋白质图谱,以此了解疾病的致病机制。
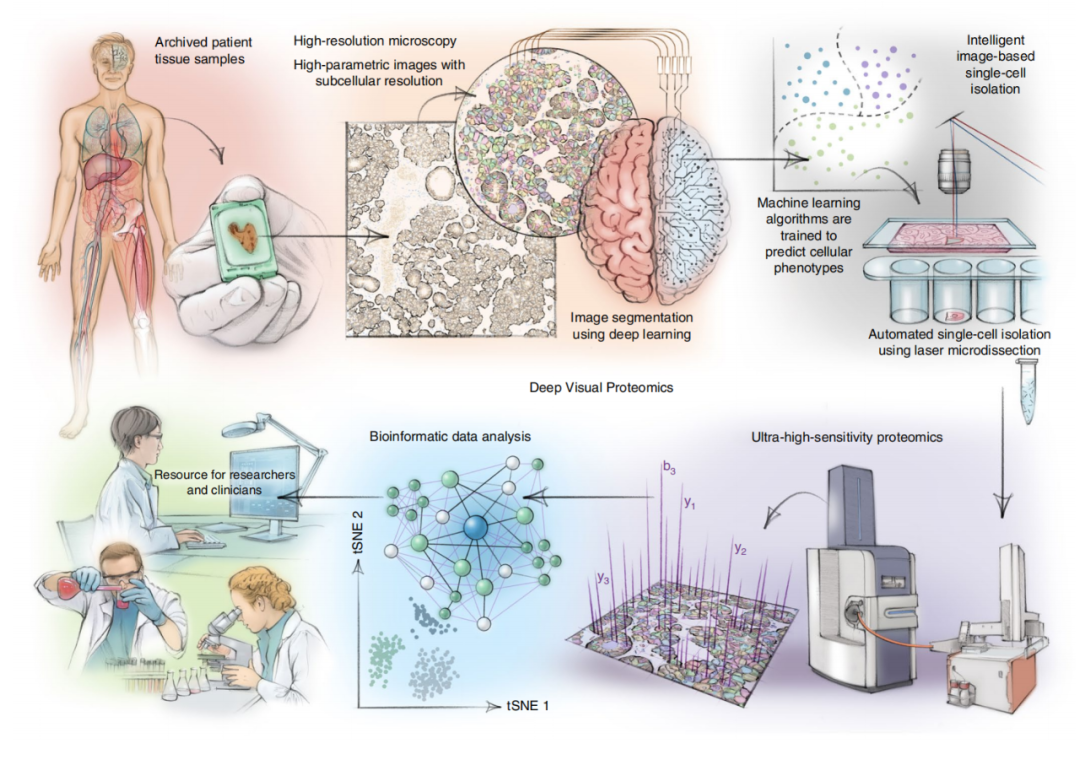
DVP技术的概念和工作流程
利用这项技术,研究人员可以有效地将显微镜下看到的细胞的生理特征与蛋白质的功能联系起来,将蛋白质丰度与复杂的细胞或亚细胞表型联系起来,同时保留空间背景。这在以前是不可能实现的。
该研究的第一作者 Andreas Mund 副教授表示:“深度视觉蛋白质组学是我们的新概念,它可能成为分子病理学的游戏规则改变者。通过这项新技术,我们可以识别数千种蛋白质,并确定其具体种类。”
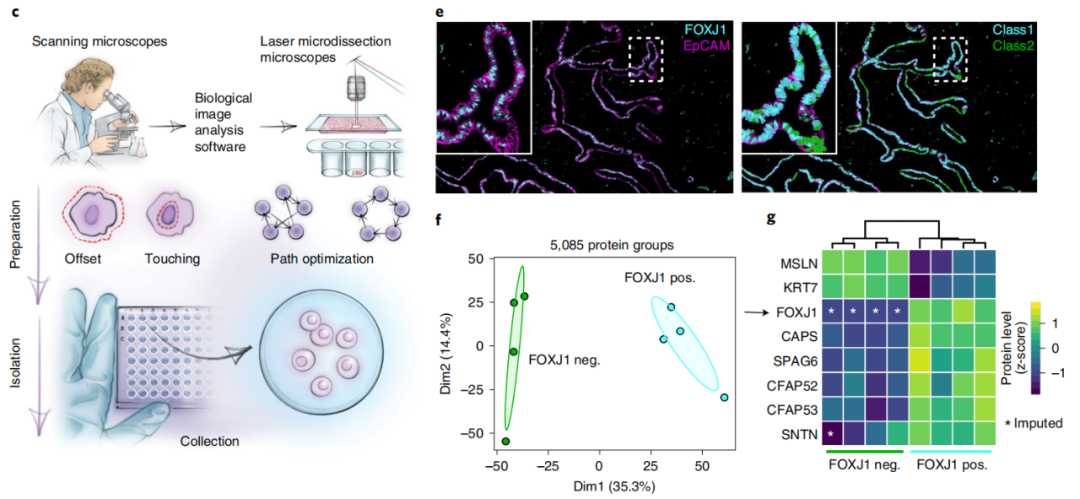
DVP技术可以识别数千种蛋白质,并确定其具体种类
在原发性黑色素瘤组织中,研究团队通过 DVP 技术发现,当正常黑色素细胞转变为完全侵袭性黑色素瘤时,空间分辨的蛋白质组发生了变化,如转移性垂直生长中的 mRNA 剪接失调,这与减少的干扰素信号转导和抗原呈递一致。
更重要的是,DVP 技术所挖掘到的蛋白质组信息揭示了驱动肿瘤发展的机制,并指导从癌症患者活检的单个组织切片中直接寻找新的治疗靶点。
对此,Andreas Mund 副教授兴奋地表示,DVP 技术暴露了癌细胞内部的分子宇宙!当我们生病时,细胞的内部的蛋白质组会发生变化,正因为如此,绘制蛋白质图谱可以帮助我们确定为什么肿瘤会在特定患者身上发生,这种肿瘤有哪些弱点,以及哪种治疗策略可能被证明是最有益的。

DVP技术应用于原发性黑色素瘤组织的蛋白质组学分析
Andreas Mund 副教授还表示,DVP 技术不仅可以用于癌症的诊断分析,还可以应用其他疾病。由于一张切片可以包含数十万个细胞,DVP 可以发现和描述罕见的细胞状态和相互作用。与单细胞转录组相比,DVP 可以很容易地分析细胞外基质(ECM)的亚细胞结构和空间动力学。此外,随着蛋白质组学技术的进一步改进,DVP 也应该适合在单细胞水平上研究蛋白质形态和翻译后修饰。
总而言之,这项研究基于显微技术、人工智能和质谱分析开发了一项新的蛋白质组学分析技术——深度视觉蛋白质组学(DVP),该技术可以在组织环境中保留精确空间蛋白质组信息的能力,对临床样本的分子谱分析具有重要意义,也有望为癌症等难以捉摸的疾病提供新的治疗方法和策略。
原始出处:
Mund, A., Coscia, F., Kriston, A. et al. Deep Visual Proteomics defines single-cell identity and heterogeneity. Nat Biotechnol (2022). https://doi.org/10.1038/s41587-022-01302-5.
作者:nagashi
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#Nat#
41
#Bio#
51
#Biotech#
58
#TEC#
55
#白质#
42